-
下列说法与“绿水青山就是金山银山”的绿色发展理念不一致的是
A. 将工业废液排入海洋以减少河道污染
B. 推广煤的液化、气化技术以提高煤的使用效率
C. 利用CO2制成全降解塑料可缓解日益严重的“白色污染”
D. 采用催化转化技术可将汽车尾气中的NOx和CO转化为无毒气体
难度: 中等查看答案及解析
-
下列物质中不会因见光而分解的是
A. AgI B. HNO3 C. NaHCO3 D. HClO
难度: 简单查看答案及解析
-
下列有机物命名正确的是
A.
 2-乙基丙烷 B. CH3CH2CH2CH2OH 1-羟基丁烷
2-乙基丙烷 B. CH3CH2CH2CH2OH 1-羟基丁烷C.
 对二甲苯 D.
对二甲苯 D. 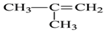 2-甲基-2-丙烯
2-甲基-2-丙烯难度: 简单查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A. 氘(D)原子核外有1个电子 B. 1H与D互称同位素
C. H2O与D2O互称同素异形体 D. 1H218O与D216O的相对分子质量相同
难度: 简单查看答案及解析
-
下列有关氮原子的化学用语错误的是
A.
B.
C. 1s22s22p3 D.

难度: 简单查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系,下列说法正确的是
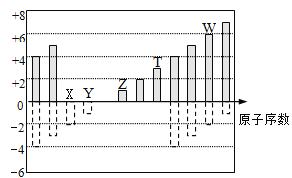
A. 最高价氧化物对应水化物酸性: Y>W>T
B. 气态氢化物的稳定性: W>X
C. 单质还原性:T>Z
D. Z、T、W的最高价氧化物对应水化物可以相互反应
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. 常温下0.1 mol/L CH3COONa溶液的pH大于7
B. CH3COOH溶液与Zn反应放出H2
C. CH3COOH溶液与Na2CO3反应生成CO2
D. 0.1mol/L CH3COOH溶液可使紫色石蕊变红
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关钠及其化合物叙述错误的是。
A. 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA个
B. 1molNa2O2与足量的水反应,转移的电子数为2NA个
C. 常温下,2.3g钠投入到100mL水中,钠失去的电子数为0.1NA
D. 0.1mol钠在空气中完全燃烧生成Na2O2,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到目的的是
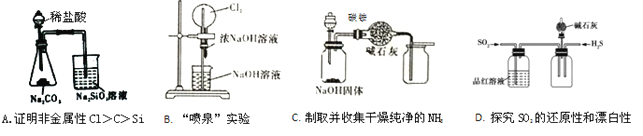
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A. Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多
B. Na2O2能分别与H2O、 CO2反应,可用作供氧剂
C. 生石灰吸水能力强,常用作袋装食品的干燥剂
D. 铝是活泼的金属单质,铝可用于冶炼某些熔点较高的金属
难度: 简单查看答案及解析
-
反应2H2O2(l)
2H2O(l)+O2(g)能量变化如图所示,下列说法正确的是

A. 由于分解反应,所以该反应吸热
B. 途径b改变了反应的热效应
C. 1 molH2O2(l)的能量高于1 molH2O(l)的能量
D. 途径a放出的热量多
难度: 简单查看答案及解析
-
下列物质的工业生产原理不涉及氧化还原反应的是
A. 氨气 B. 纯碱 C. 硫酸 D. 溴单质
难度: 简单查看答案及解析
-
下列关于物质结构的叙述中正确的是
A.分子晶体中一定含有共价键
B.离子晶体中一定含有离子键
C.含有极性键的分子一定是极性分子
D.含有非极性键的分子一定是非极性分子
难度: 中等查看答案及解析
-
以下除杂方法(括号内为杂质)中,错误的是
A. CH3CH2OH(H2O):加CaO,蒸馏
B. NaCl(I2):加热,升华
C. NaCl(KNO3):配成溶液,降温结晶
D. 溴苯(溴):加NaOH溶液,分液
难度: 中等查看答案及解析
-
右表为部分一氯代烷的结构简式和一些性质数据,下列对表中物质与数据的分析归纳错误的是
序号
结构简式
沸点/℃
相对密度
①
CH3Cl
-24.2
0.9159
②
CH3CH2Cl
12.3
0.8978
③
CH3CH2CH2Cl
46.6
0.8909
④
CH3CHClCH3
35.7
0.8617
⑤
CH3CH2CH2CH2Cl
78.44
0.8862
⑥
CH3CH2CHClCH3
X
0.8732
⑦
(CH3)3CCl
52
0.8420
A. 52℃<X<78.44℃
B. 物质①②③⑤互为同分异构体
C. 一氯代烷的范德华力随碳原子数的增多而趋于升高
D. 一氯代烷的相对密度随碳原子数的增多而趋于减小
难度: 简单查看答案及解析
-
下图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是
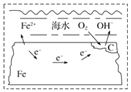
A. 该金属腐蚀过程为析氢腐蚀
B. 正极为C,发生的反应为氧化反应
C. 在酸性条件下发生的是吸氧腐蚀
D. 正极反应为O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
下列物质间反应,可以用离子方程式2H++CO32-=CO2↑+H2O表示的是
A. 碳酸钠与醋酸 B. 碳酸氢钠与盐酸
C. 大理石与盐酸 D. 碳酸钾与硫酸
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化,均能通过一步化学反应实现的是
A.
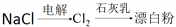 B.
B. 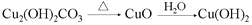
C.
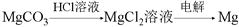 D.
D. 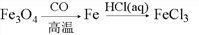
难度: 中等查看答案及解析
-
某溶液中除H+、OH— 外,还有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量之比为1:1:6,下列有关该溶液的判断正确的是
A. 向该溶液中加入稀NaOH溶液,立即产生白色沉淀
B. 将该溶液滴在KI淀粉试纸上,试纸变蓝
C. 若该溶液的pH为1,则c (Mg2+)=0.2mol/L
D. 向该溶液中加入过量铁粉,只有一种阳离子与铁反应
难度: 困难查看答案及解析
-
将2.68克KCl和KBr的混合物,溶于水配成500ml溶液,通入过量的Cl2,反应后将溶液蒸干,得固体2.235克。则原来所配溶液中Cl-、Br-、K+的物质的量之比为
A. 3︰2︰1 B. 1︰2︰3 C. 1︰3︰2 D. 2︰1︰3
难度: 简单查看答案及解析



 的合成路线。合成路线常用的表示方式为:_______________
的合成路线。合成路线常用的表示方式为:_______________