-
(15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.直型冷凝管
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
-
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
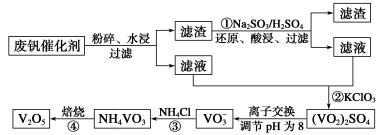
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
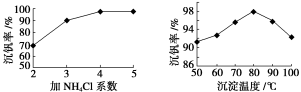
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+  VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
-
(14分)工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是____________________。
(2)已知2SO2 (g)+ O2 (g) 2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L容积固定不变的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=____________。
②在①的条件下,判断该反应达到平衡状态的标志是_______(填字母)。
A.SO2 、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2 的生成速率和SO3的生成速率相等
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率 氧气的转化率(填大于、小于或等于)。
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
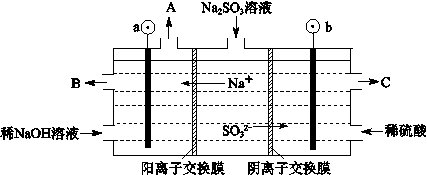
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。
-
(15分)工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝。
(1) 一座大型硫酸厂同时又是一座能源工厂,硫酸厂生产过程中的余热若能充分回收利用,不仅不需要外界供应能源,而且还可以向外界输出大量的热能。硫酸厂产生余热的主要设备有________。
(2)硫酸厂产生的大量烧渣(硫铁矿煅烧后的灰渣)的用途是________(写一种即可);写出电解精炼铜阳极泥的一种用途________。
(3) 工业制硫酸的尾气中含有的少量SO2,可先用氨水吸收,再用稀硫酸处理。
①该反应的化学方程式为_________; ②这样处理的优点是____________________。
(4)干熄焦技术是将炼焦炉推出的约1 000℃的赤热焦炭,在熄焦室中被其逆流的冷惰性气体(主要成分是氮气,温度在170~190℃)熄灭,被加热到700~800℃的惰性气体经除尘后进入余热锅炉,产生的过热蒸气送往汽轮发电机发电。干熄1 t焦炭可产生500 kg过热蒸气,可折合成46 kg标准煤。举出两例采用逆流原理的化工设备或化学仪器________、________。
(5)下图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式 。

-
(15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
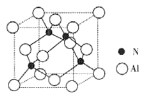
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键 B.共价键 C.配位键 D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
-
[化学――选修5:有机化学基础](15分)
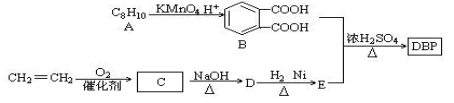
添加塑化剂可改善白酒等饮料的口感,但不应超过规定的限量。DBP是一种酯类塑化剂,可由下列路线合成:
已知以下信息:
①
② (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 ;
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: ;
(4)写出2种同时符合下列条件的B的同分异构体结构简式 ;
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 ,
 ,关于有机物M的说法正确的是
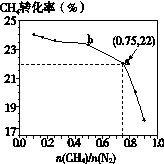
,关于有机物M的说法正确的是3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示: