-
下列关于水的说法中正确是
A. 在任何条件下,纯水都呈中性
B. 在任何条件下,纯水的pH=7
C. 在95℃时,纯水中 c(H+)<l0﹣7mol/L
D. 向纯水中加入少量 NaOH固体,水的电离逆向移动,c(OH﹣)降低
难度: 中等查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项
强电解质
弱电解质
非电解质
A
CaCO3
H2SiO3
酒精
B
NaCl
NH3
BaSO4
C
Fe
CH3COOH
蔗糖
D
HNO3
Fe(OH)3
H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确的是
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2S04
CuSO4
FeCl2
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.将FeCl3溶于盐酸配制FeCl3溶液
B.加热稀醋酸溶液其pH降低
C.用低浓度铁盐溶液获得纳米氧化铁
D.小苏打溶液与AlCl3溶液混合产生气体和沉淀
难度: 中等查看答案及解析
-
下列说法中正确的是
A. CuCl2溶液蒸干灼烧后得到CuCl2固体
B. 火力发电的目的是使化学能转换为电能
C. 已知C(石墨,s)= C(金刚石,s)△H>0,无法比较二者的稳定性
D. 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液
难度: 中等查看答案及解析
-
一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断一定正确的是
A. 加入的碱过量 B. 生成的盐发生水解
C. 反应后溶液中c(A-) = c(M+) D. 混合前酸与碱中溶质的物质的量相等
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H+ + OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
一定温度下,反应N2(g)+O2(g)
2NO(g) 在密闭容器中进行,下列措施不改变化学反应速率的是
A. 缩小体积使压强增大 B. 恒容,充入N2 C. 恒容,充入He D. 恒压,充入He
难度: 中等查看答案及解析
-
下列各组离子中,在给定条件下能大量共存的是
A.在pH = 1的溶液中:NH4+、K+、ClO-、Cl-
B.有SiO32-存在的溶液中:Na+、Mg2+、Al3+、Cl-
C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br-
D.在c(H+) = 1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
难度: 中等查看答案及解析
-
25℃时,在100mL 0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,下列说法正确的是(已知25℃时, AgCl的Ksp=1.8×10-10)
A. 有AgCl沉淀析出 B. 无AgCl沉淀析出
C. 有沉淀析出,但不是AgCl D. 无法确定是否有沉淀析出
难度: 中等查看答案及解析
-
对某难溶电解质AnBm的饱和溶液中,下列说法正确的是
A. 加同温度的水,其溶度积减小、溶解度增大
B. 升高温度,它的溶解度和溶度积都增大
C. 饱和溶液中c(Am+)=c(Bn﹣)
D. 加同温度的水,其溶度积、溶解度均不变
难度: 困难查看答案及解析
-
下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
难度: 简单查看答案及解析
-
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)⇌Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. 体系压强不再变化 D. Z的浓度不再变化
难度: 困难查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
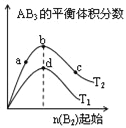
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
难度: 困难查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. c(Z)=0.4 mol/L B. c(X2)=0.2mol/L
C. c(Y2)=0.4mol/L D. c(X2)+c(Y2)+c(Z)=0.6mol/L
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1mol•L﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
难度: 困难查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
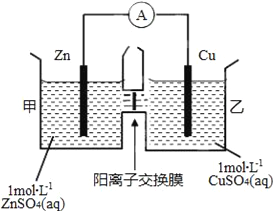
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42﹣)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
如图所示三个烧瓶中分别装入含酚酞的0.01mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.则下列叙述正确的是

A. ①说明水解反应为放热反应 B. ③说明水解反应为吸热反应
C. ①中溶液红色变浅 D. ③中溶液红色变深
难度: 中等查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-=2CO32-+12H2O。有关此电池的推断不正确的是
A. 通入氧气的电极为正极
B. 参加反应的O2与C2H6的物质的量之比为7∶2
C. 放电一段时间后,KOH的物质的量浓度将下降
D. 放电一段时间后,正极区附近溶液的pH减小
难度: 困难查看答案及解析
-
如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是
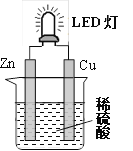
A. 铜片表面有气泡生成
B. 装置中存在“化学能→ 电能→ 光能”的转换
C. 如果将硫酸换成柠檬汁,导线中不会有电子流动
D. 如果将锌片换成铁片,电路中的电流方向不变
难度: 中等查看答案及解析
-
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)
2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
改变条件
新平衡与原平衡比较
A
升高温度
X的转化率变小
B
增大压强
X的浓度变小
C
充入一定量Y
Y的转化率增大
D
使用适当催化剂
X的体积分数变小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列装置或操作能达到目的的是
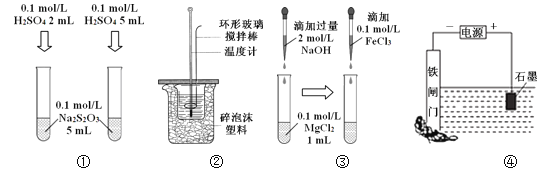
A. 装置①探究H2SO4浓度对反应速率的影响 B. 装置②可用于测定中和热
C. 装置③探究Mg(OH)2能否转化成Fe(OH)3 D. 装置④不能保护铁闸门被腐蚀
难度: 中等查看答案及解析
-
某同学组装了如右图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是

A. 电流方向:电极Ⅳ → ○ → 电极Ⅰ
B. 盐桥中的K+会移向ZnSO4溶液
C. III处得到气体2.24L,电极II上析出6.4g固体
D. NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 明矾和漂白粉常用于自来水的净化和消毒,两者原理相同
B. 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小
C. 等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D. FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深
难度: 中等查看答案及解析
 CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。