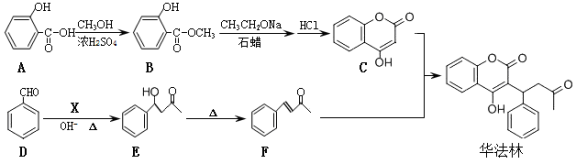
-
下列物质无法从海水中获得的是
A.硫酸 B.氯化镁 C.溴 D.氢氧化钠
难度: 简单查看答案及解析
-
下列关于有机物的判断错误的是
A.乙烯和苯使溴水褪色的原理不同
B.乙醇、乙酸都能和金属钠反应
C.C2H6O只代表一种物质
D.淀粉和纤维素都可作为工业上生产葡萄糖的原料
难度: 简单查看答案及解析
-
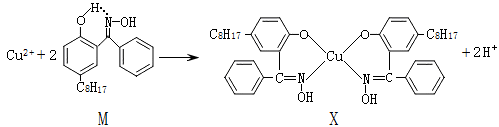
四种短周期元素在周期表中的位置如右图,其中X元素的原子最外层电子数等于其电子层数。
下列说法不正确的是
Z
W
X
Y
A.X位于元索周期表中第3 周期、ⅢA族
B.原子半径:X > Z > W
C.最简单气态氢化物的热稳定性:W > Y
D.Y的最高价氧化物可以和W的最简单氢化物反应
难度: 中等查看答案及解析
-
常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列
有关叙述正确的是
A.加入适量的NaCl,可使c(NH4+) = c(Cl-)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸,
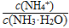 的值减小
的值减小D.1.0 mol·L-1的NH4Cl溶液中c(NH4+)比该混合溶液大
难度: 中等查看答案及解析
-
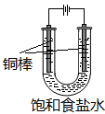
探究浓硫酸和铜的反应,下列装置或操作正确的是
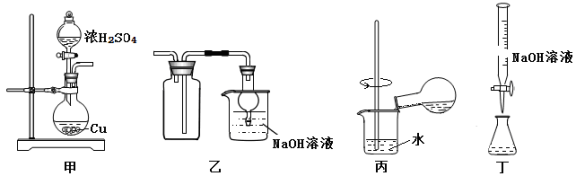
A.用装置甲进行铜和浓硫酸的反应
B.用装置乙收集二氧化硫并吸收尾气
C.用装置丙稀释反应后的混合液
D.用装置丁测定余酸的浓度
难度: 中等查看答案及解析
-
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是
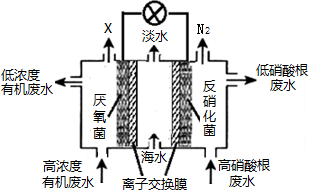
A.中间室Cl—移向左室
B.X气体为CO2
C.处理后的含硝酸根废水pH降低
D.电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
难度: 困难查看答案及解析
-
某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线,如图。下列说法不正确的是
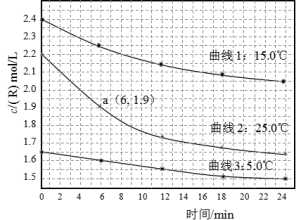
A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
难度: 困难查看答案及解析