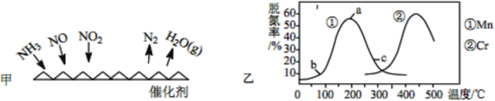-
硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:4NO+4NH3+O2 4N2+6H2O;6NO2+8NH3
4N2+6H2O;6NO2+8NH3 7N2+12H2O。
7N2+12H2O。
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化合物的平均相对分子质量为___。
(2)尾气中NO的含量为___mg/m3。
(3)要处理5m3的尾气,需要氨氧混合气的体积为___L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
(4)NaOH溶液的物质的量浓度为___mol/L,体积为___mL。
(5)已知反应后溶液中含有0.35molNaNO2。若将尾气中NO与NO2的平均组成记为NOx,通过计算求x___。
-
氮的氧化物(NOx)是大气污染物之一。工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),常见处理法有:
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx (2x+3)N2+6xH2O
(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
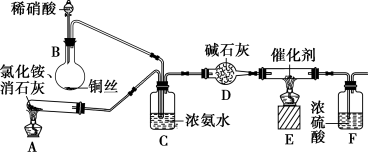
①装置A中发生反应的化学方程式为________________________________。
②装置D中碱石灰的作用是____________________。
(2)用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3===NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________(填字母)。
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则NOx中的x值为________________。
-
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx (2x+3)N2+6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:
(2x+3)N2+6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:
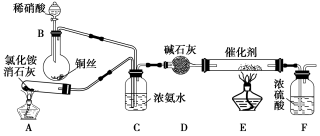
①装置A中发生反应的化学方程式为_____________________。
②装置D中碱石灰的作用是_____________________________。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2(Ⅰ)
2NO2+Na2CO3=NaNO2+NaNO3+CO2(Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________(填字母)。
A.1.9 B.1.7 C.1.2
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO、NO两种离子的物质的量随x变化关系如图所示:
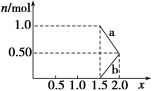
图中线段a表示____________的物质的量随x值变化的关系;若用溶质质量分数为42.4%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则NOx中的x值为____________。
-
硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的尾气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A.在用氨气处理氮氧化物时,氮氧化物发生还原反应
B.所得溶液中NaNO3和NaNO2的物质的量之比可能为2:1
C.若用氨气处理,所需氨气在标准状况下的体积可能为39.2L
D.原混合气体中NO在标准状况下的体积可能为16.8L
-
工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物NOx(NO和NO2的混合物,假设不含N2O4)的处理与应用也是科学研究的热点。
⑴工业上可用氨催化吸收法处理NOx,反应原理为4xNH3+6NOx (2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
(2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
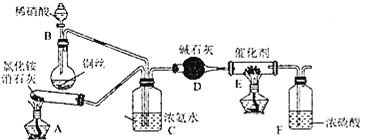
①装置A中发生反应的化学方程式为________。
②装置D中碱石灰的作用是________。
⑵工业上也常用Na2CO3溶液吸收法处理NOx(已知:NO不能与Na2CO3溶液反应)。NO+NO2+ Na2CO3 = 2 NaNO2+ CO2;
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2。
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________ 填选项字母
填选项字母 。
。
A.1.4 B.1.6 C.1.8
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示:
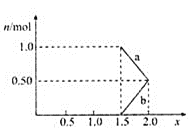
图中线段a表示________ 填化学式
填化学式 随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
 用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的
用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的 ________。
________。
⑶氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气的意义是________。
⑷尿素也可用于吸收处理NOx,其反应原理为NO+NO2+ H2O = 2HNO2、2HNO2+CO(NH2)2 = 3H2O + CO2↑+ 2N2↑。当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)= ________ (空气中O2的体积含量约为20%)。
-
工业制硝酸的尾气中含有N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
I.工业制硝酸:
(1)氨催化氧化法是工业制硝酸的基础反应,写出氨催化氧化的化学方程式为___。
II.含氮氧化物的尾气处理:
(2)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解,N2O分解的化学方程式为___。
(3)NO和NO2的处理。已知NO、NO2在碱溶液中可以发生如下反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+NO3-+H2O
①下列措施能提高尾气中NO和NO2去除率的有___(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.将尾气通入NaOH溶液的同时通入空气可以提高尾气的吸收率
② 含NO和NO2的尾气可用NaOH溶液吸收,吸收后的溶液经___、过滤,得到NaNO2晶体。
③ 吸收后排放的尾气中含量较高的氮氧化物是___(填化学式)。
(4)用NaClO溶液吸收尾气。用NaClO溶液代替NaOH溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
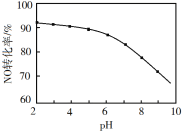
①在酸性NaClO溶液中,HClO氧化NO生成NO3-时发生反应的离子方程式为___。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___。
-
氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
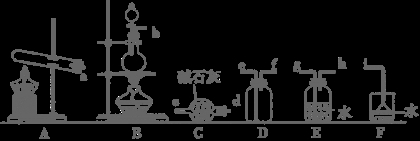
①氨气的发生装置可以选择上图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2 (两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
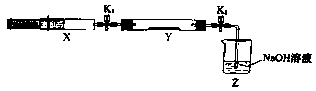
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开 | ③ | ④ |
-
氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示
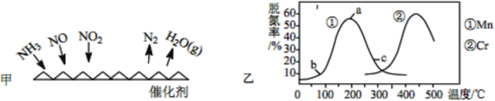
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
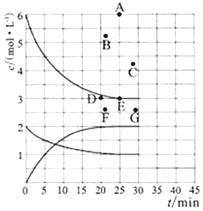
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时, =_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
=_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
-
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
-
大气中的含氮化合物主要来源于汽车尾气与工业废气排放。
(1)催化转化器可使汽车尾气中的主要污染物 、
、 进行相互反应,生成无毒物质,减少汽车尾气污染。
进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:





计算尾气转化反应 的
的 ________。
________。
(2) 催化还原氮氧化物
催化还原氮氧化物 技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:
技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:
 。反应在
。反应在 密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生
密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。
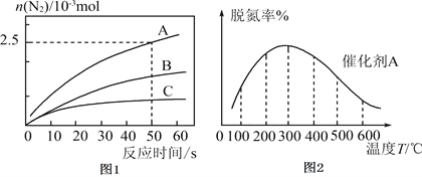
①下列有关说法正确的是___________。
 反应在任何温度下均可自发进行
反应在任何温度下均可自发进行
 在催化剂A作用下,经历
在催化剂A作用下,经历 ,平均反应速率
,平均反应速率
 使用催化剂C,达到平衡时,
使用催化剂C,达到平衡时, 产率最小
产率最小
 分离出反应体系中的
分离出反应体系中的 有利于氮氧化物的脱除
有利于氮氧化物的脱除
②实验室在 密闭容器中加入
密闭容器中加入 、
、 ,达到平衡时氮氧化物脱氮率为
,达到平衡时氮氧化物脱氮率为 ,则平衡常数
,则平衡常数 ____________
____________ ;
; 只列出计算式,不必求出计算结果
只列出计算式,不必求出计算结果
③在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内, 之前,温度升高脱氮率逐渐增大,
之前,温度升高脱氮率逐渐增大, 之后温度升高脱氮率逐渐减小
之后温度升高脱氮率逐渐减小 假设催化剂活性不受影响
假设催化剂活性不受影响 ,写出脱氮率随温度变化的原因_________________。
,写出脱氮率随温度变化的原因_________________。
(3)以连二硫酸根 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
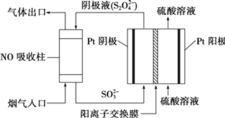
①阴极区的电极反应式为_________________;
②通电,当电路中转移 电子时,可吸收的NO在标准状况下的体积为
电子时,可吸收的NO在标准状况下的体积为 。则NO转化后的产物的化合价为_________________。
。则NO转化后的产物的化合价为_________________。
4N2+6H2O;6NO2+8NH3
7N2+12H2O。