-
甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
① CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
② CO(g)+2H2(g) CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5 MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1 L密闭容器中充入1 mol CO2和3 mol H2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5 mol H2和0.5 mol H2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
-
甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
① CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
② CO(g)+2H2(g) CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5 MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1 L密闭容器中充入1 mol CO2和3 mol H2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5 mol H2和0.5 mol H2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
| 化学键 | H-H | C=O | C≡O | H-O |
| E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
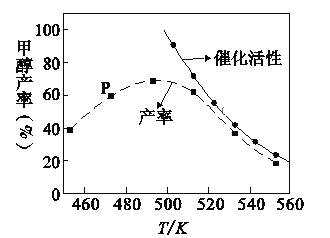
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
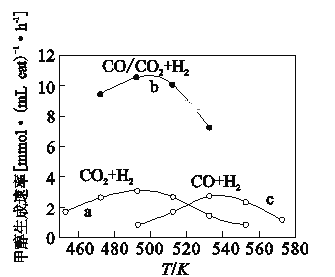
①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2 CO
CO CH3OH II.CO
CH3OH II.CO CO2
CO2 CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
-
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)  CH3OH(g) △H1②CO2(g)+3H2(g)
CH3OH(g) △H1②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)
CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)  CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=___________kJ•mol-1;已知△H2= -58 kJ•mol-1,则△H3= ____________kJ•mol-1。
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为___________.正极的电极反应式为________________.
(3)下图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
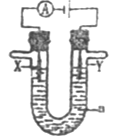
①若X为铁,Y为银,a为一定浓度的硝酸银溶液,通电后,Y极板上发生的电极反应式为:_____。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气_______L(假设空气中氧气体积分数为20%)。
-
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | 
| H—O | C—H |
| E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。
-
(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
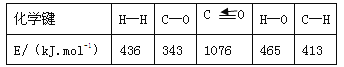
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
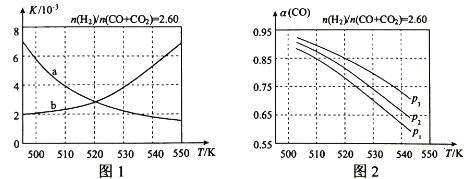
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
-
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/( kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJ•mol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
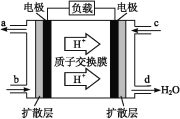
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
-
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 
| H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-99kJ·mol-1
CH3OH(g) ΔH1=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)ΔH3=__kJ·mol-1。
(2)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响如图所示。
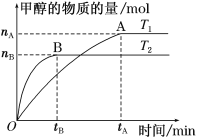
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=__mol·L-1·min-1。
②图示的温度T1__T2(填写“>”、“<”或“=”)。
(3)T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为__,其平衡常数的数值为__。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1=—99kJ.mol-1,
CH3OH(g)△H1=—99kJ.mol-1,
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式__________。
(2)由上述数据计算出△H3=kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是__________(填序号)
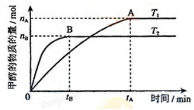
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tAmol/(L·min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;该温度条件下,反应平衡常数为__________(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为__________。
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
CH3OH(g) ΔH2=-90.77 kJ/mol K2
CO(g)+H2O(g) ΔH3 K3







