-
天然石灰石是工业生产中重要的原材料之一,它的主要成分是 CaCO3,一般以CaO 的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
Ⅰ.称取 a g 研细的石灰石样品于 250 mL 烧杯中,加过量稀盐酸溶解,水浴加热 10 分钟;
Ⅱ.稍冷后逐滴加入氨水至溶液 pH≈4,再缓慢加入适量(NH4)2C2O4 溶液,继续水浴加热30 分钟;
Ⅲ.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4 溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出 Cl−;
Ⅳ.加入适量热的稀硫酸至沉淀中,获得的溶液用 c mol·L−1 KMnO4 标准溶液滴定至终点。
Ⅴ.平行测定三次,消耗KMnO4 溶液的体积平均为 V mL。
已知:H2C2O4 是弱酸;CaC2O4 是难溶于水的白色沉淀。
⑴Ⅰ中为了加快反应速率而采取的操作有_____。
⑵Ⅱ中加入氨水调节溶液 pH 的作用是_____。
⑶Ⅲ中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4 溶液洗涤沉淀的目的__________________________。
②检测洗涤液中无 Cl−的试剂和现象是__________________________。
③若沉淀中的 Cl−未洗涤干净,则最终测量结果_____(填“偏大”、“偏小”或“不变”)。
⑷Ⅳ中用 KMnO4 标准溶液滴定。
①滴定时发生反应的离子方程式为_____。
②滴定至终点的现象为_____。
③样品中以CaO 质量分数表示的钙含量为_____(列出表达式)。
高三化学实验题简单题查看答案及解析
-
氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
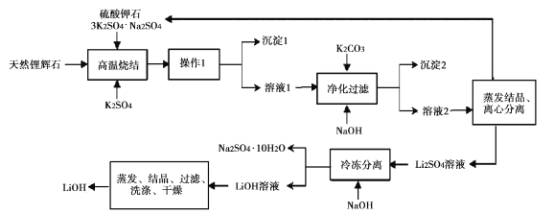
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
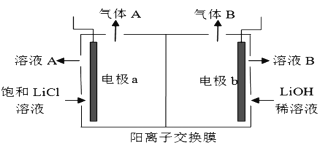
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
高三化学综合题中等难度题查看答案及解析
-
氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
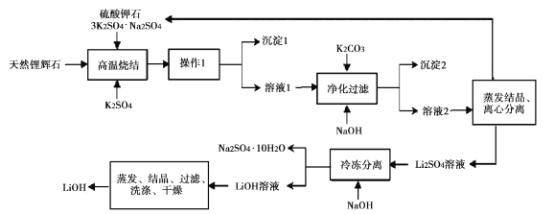
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
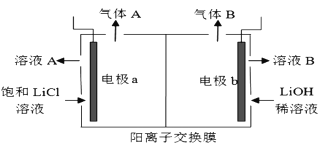
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
高三化学综合题中等难度题查看答案及解析
-
高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为
高三化学单选题中等难度题查看答案及解析
-
煤作为主要的能源物质,在国民生产和生活中起重要作用,但直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石(主要成分:CaCO3)浆液的脱硫装置可以除去其中的 SO2气体,最终生成硫酸钙。硫酸钙可在如图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于 CO2的回收利用,达到减少碳排放的目的。
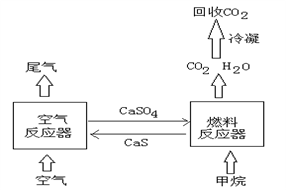
请回答下列问题:
(1)煤燃烧产生的烟气直接排放在空气中,不会引发的环境问题是(______)
A. 温室效应 B. 酸雨 C. 粉层污染 D. 水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通过一段时间的CO2,以增加脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的Ca(HSO3)2可以快速被氧化为CaSO4。
①从分子结构看,CO2是由_____ 共价键构成的_____分子(选填:“极性”或“非极性”)。它与石灰石浆液反应的属于 _________反应。(选填“化合”、“分解”、“置换”、“复分解”),固体的CO2被称为干冰,其受热很容易_______。(填一种物理现象)
②Ca(HSO3)2从晶体类型看属于_____晶体,它溶于蒸馏水的电离方程式为______________________,它与足量氧气反应生成硫酸氢钙的化学方程式是_________________。用单线桥表示出反应物中电子转移的数目和方向:____________________。
③回收的CO2与酚羟基的钠盐在一定条件下反应,生成有机物M,其化学式为C7H5O3Na,M经过稀硫酸酸化后得到一种药物中间体N,N的结构简式为:
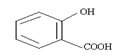
M的结构简式为________________除苯基外,药物中间体N所含的官能团还有______________(填写“中文名称”)N在一定条件下可以经过自身缩聚形成一种高分子化合物,试写出形成高分子的化学反应:__________________。分子中无 -O-O- ,醛基与苯环直接相连的N的同分异构体共有_______种。
高三化学简答题困难题查看答案及解析
-
水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
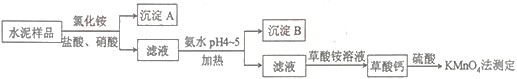
回答下列问题:
(1)沉淀A的主要成分是__。
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__,请写出相应的离子方程式:__。
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
___MnO
+___H++___H2C2O4——___Mn2++___CO2+___H2O
②求该水泥样品中钙的质量分数为___。
高三化学实验题中等难度题查看答案及解析
-
生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)
CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
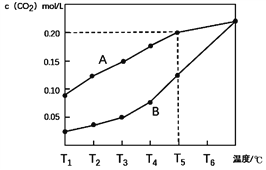
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)CaCO3(s)
CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
(2)在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为____克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为____克。
(3)请说明随着温度升高,曲线B向曲线A逼近的原因____
(4)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。
相关主要反应如下:
I. C(s) + H2O(g)
CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g)
CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g)
CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s)
CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=____
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
A. 适当的降低体系的温度 B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气 D. 增加CaO的量
(5)将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03moL·L-1,水的pH约等于6,这种情况下钙离子最大浓度为____moL·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9,碳酸K1=4.3×10-7 K2=4.7×10-11)
高三化学综合题中等难度题查看答案及解析
-
某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分
ZnO
CaO
Fe2O3
SiO2
其它
质量分数/%
81
0.098
1.14
0.5
————
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:
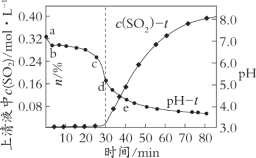
(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
高三化学填空题中等难度题查看答案及解析
-
某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分
ZnO
CaO
Fe2O3
SiO2
其它
质量分数/%
81
0.098
1.14
0.5
————
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:
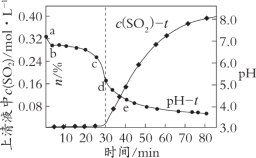
(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
高三化学综合题中等难度题查看答案及解析
-
碱式碳酸镁
是重要的无机化工产品。一种由白云石
主要成分为
,还含少量
、
等
为原料制备碱式碳酸镁
国家标准中CaO 的质量分数
的实验流程如下:
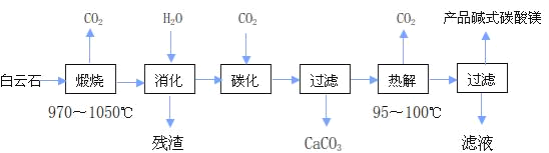
“煅烧”时发生主要反应的化学方程式为________________。
常温常压下“碳化”可使镁元素转化为
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
图1 CaO含量与碳化终点pH的关系
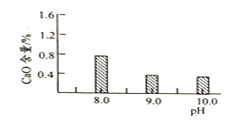
图2碱式碳酸镁产率与碳化终点pH的关系
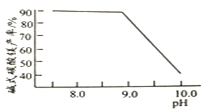
应控制“碳化”终点PH 约为__________。
图
中,当
时,镁元素的主要存在形式是__________________
写化学式
。
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
一种测定碱式碳酸镁
组成的方法如下:
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
标准状况
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
。
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
固体样品的剩余质量
固体样品的起始质量
随温度的变化如下图所示
样品在
时完全失去结晶水
。
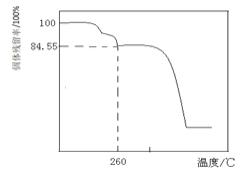
根据以上实验数据计算确定碱式碳酸镁晶体的化学式
写出计算过程
_________。
高三化学工业流程困难题查看答案及解析