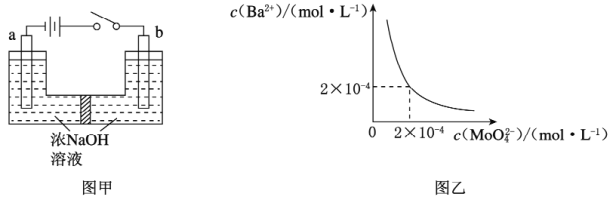-
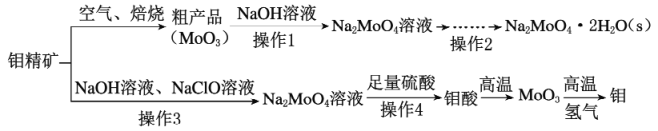
钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为_________;焙烧的产物除MoO3外的另一种是_________,产生的尾气对环境的主要危害是____________________________。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是____________________,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g,钼精矿中MoS2的质量分数为_________________________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3发生反应的离子方程式为__________________________________________________。
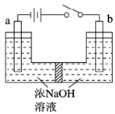
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图甲所示。b电极的材料为_______(填“镍”或“钼”),其电极反应式为_________________________________________________。
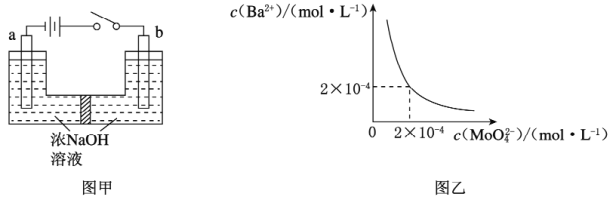
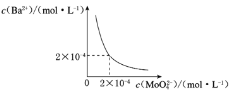
(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图乙所示,该温度下BaMoO4的Ksp为____________。
-
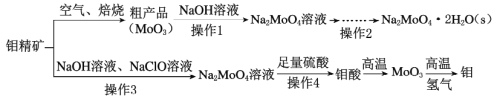
钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为____;焙烧产生的尾气对环境的主要危害是___。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是_,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为_________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3硫元素被氧化为最高价,发生反应的离子方程式为_______。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为____________。
(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为____。
-
钼(Mo)是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
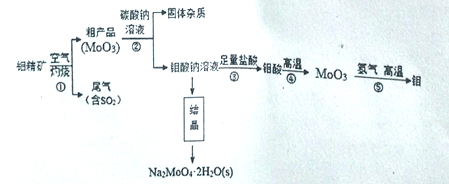
(1)Na2MoO4·2H2O中钼元素的化合价是_______,结晶得到的钼酸钠晶体时粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______(填序号)。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_________。能提高该反应速率的措施有______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式___________。
(6)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,c(CO32-)=0.52mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的去除率为______。[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
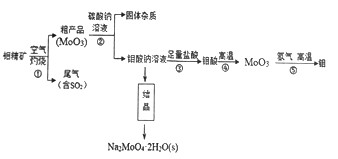
(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
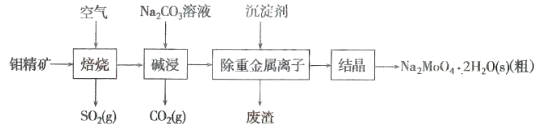
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
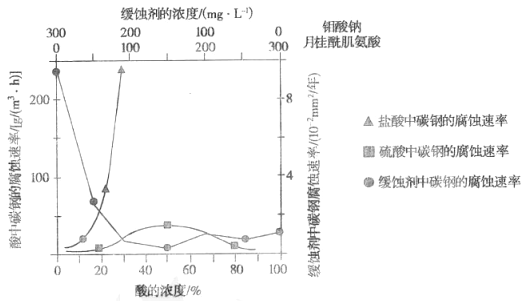
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
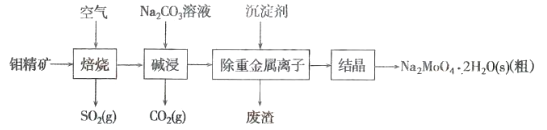
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
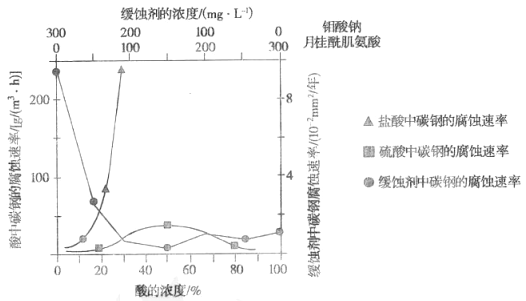
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
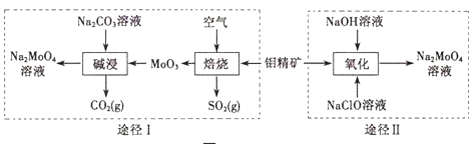
钼酸钠晶体( Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
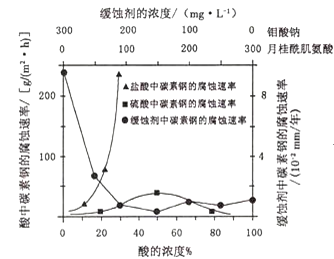
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO4•2H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO4•2H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
-
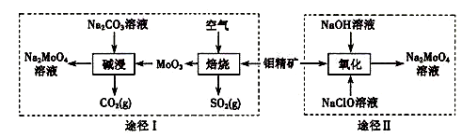
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
(1) NaClO的电子式是 。
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 。
(3)途径I碱浸时发生反应的化学反应方程式为 。
(4)途径Ⅱ氧化时发生反应的离子方程式为 。
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
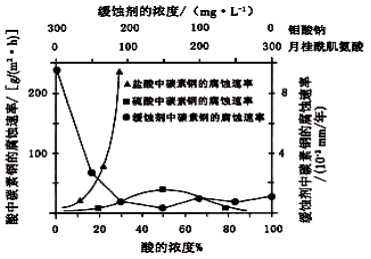
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为__ __。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
-
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
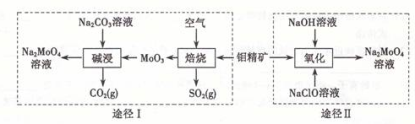
(1) NaClO的电子式是
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
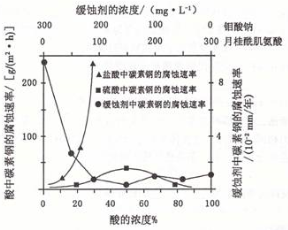
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为____。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是____。
-
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
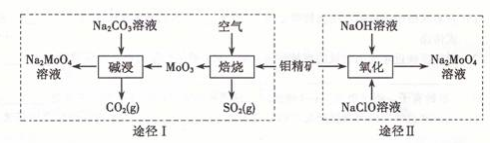
(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
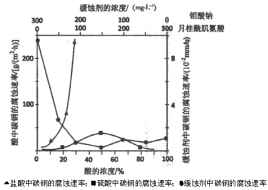
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。