-
十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)  CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)  CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)⇌CaS(s)+3CO2(g);△H=__________kJ•mol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。
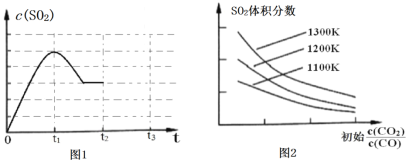
(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
-
十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g)活化能Ea1, ΔH1=+218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)⇌CaS(s)+4CO2(g)活化能Ea2, ΔH2=-175.6kJ·mol-1
已知活化能Ea1< Ea2。请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)⇌CaS(s)+3CO2(g);△H=______kJ•mol-1;该反应在______(填“高温”“低温”“任意温度”)时可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。t min中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=______(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)下图为1000 K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图象。请分析下图曲线中c(SO2)在0~t2区间变化的原因_______。
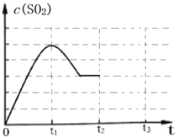
(4)下图为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比 与SO2体积分数的关系曲线。下列有关叙述正确的是_______。(填序号)
与SO2体积分数的关系曲线。下列有关叙述正确的是_______。(填序号)
A.当体系中气体的密度不再变化时,反应I和反应Ⅱ都已达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)  CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)  CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是 。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
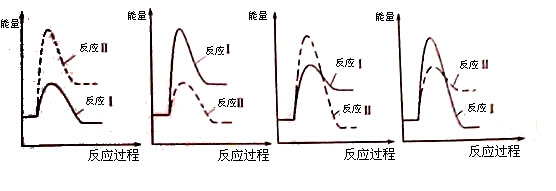
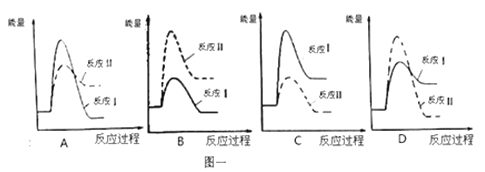
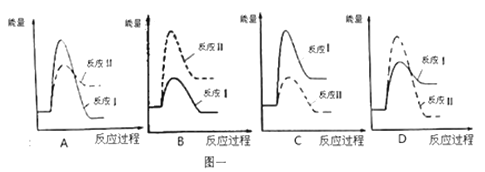
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
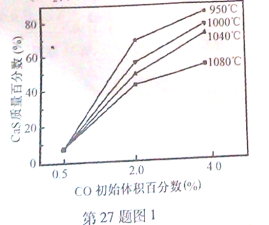
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。

-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ⇌ CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) ⇌ CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。
(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。
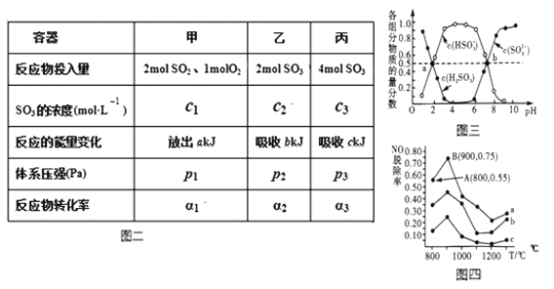
(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=−196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO (aq)+BaCO3 (s) ⇌ BaSO4 (s)+CO
(aq)+BaCO3 (s) ⇌ BaSO4 (s)+CO (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ⇌ CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) ⇌ CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。
(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。
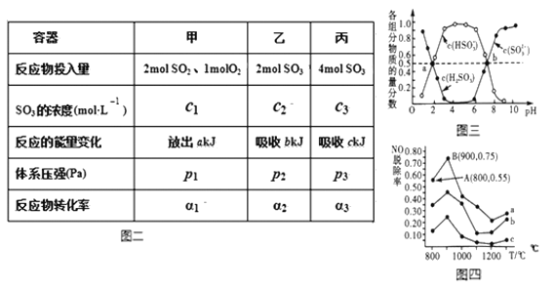
(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=−196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO (aq)+BaCO3 (s) ⇌ BaSO4 (s)+CO
(aq)+BaCO3 (s) ⇌ BaSO4 (s)+CO (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g)  CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g)  3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s) CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g)  CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A.提高反应体系的温度,能降低该反应体系中SO2生成量
B.反应II在较低的温度下可自发进行
C.用生石灰固硫的反应为:4CaO(s)+4SO2(g)  3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D.由反应I和反应II可计算出反应CaSO4(s) CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)  CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)  CaS(s)+4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是__________。
A. 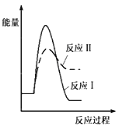 B.
B. 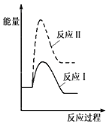
C. 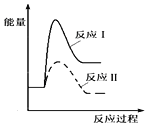 D.
D.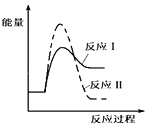
(2)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表(已知2SO2(g)+O2(g)  2SO3(g)△H=−196.6kJ·mol-1) 则:
2SO3(g)△H=−196.6kJ·mol-1) 则:
| 容器 | 甲 | 乙 | 丙 | (填>,=,<) A.2c1_____c3 B.a+b_____196.6 C.2p2____p3 D.α1+α3___1 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO3 |
| SO3的浓度 (mol·L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
(3)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
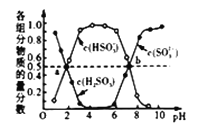
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=_____。
(4)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO  5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图所示:
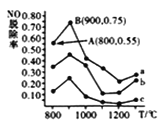
①曲线c对应NH3与NO的物质的量之比是__________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__________mg/(m3·s)。
(5)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/L Na2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO42- (aq)+BaCO3(s)  BaSO4 (s)+CO32-(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO42-)=____mol·L-1(保留小数点后两位).
BaSO4 (s)+CO32-(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO42-)=____mol·L-1(保留小数点后两位).
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___。
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H2=-175.6kJ•mol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJ•mol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp=___________ (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。
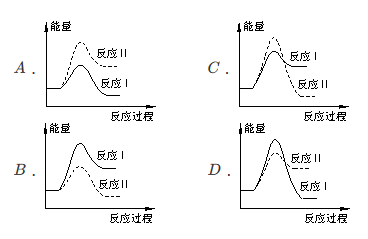
(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。
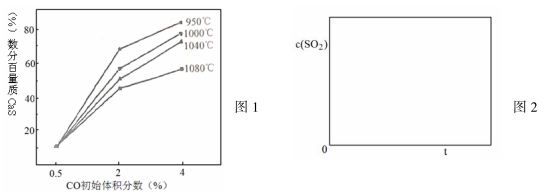

与SO2体积分数的关系曲线。下列有关叙述正确的是_______。(填序号)









 B.
B. 
 D.
D.



