-
“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
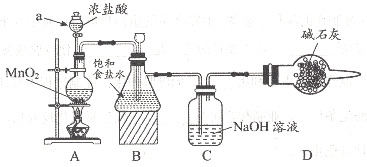
该学习小组按下图装置进行实验(部分夹持装置省去)
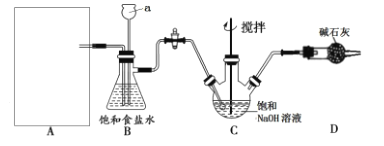
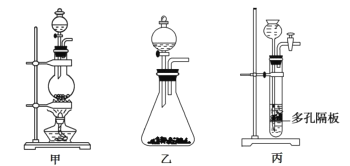
(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
| 实验内容 | 实验现象 |
| 实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
| 实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000mol•L-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2 =2I-+
=2I-+ )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
-
84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
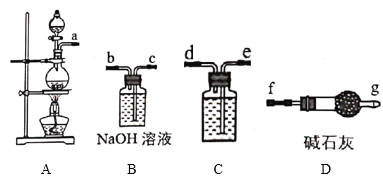
(1)A中发生反应的离子方程式为___。
(2)C中盛装试剂为__,仪器的连接顺序为a→__。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__(填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__ 。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品 ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___。
-
“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
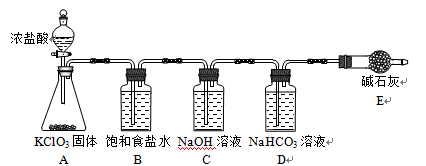
(1)该小组按上图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如下表。(已知饱和NaClO溶液pH为11)
| 实验步骤 | 实验现象 |
| B瓶 | C瓶 | D瓶 |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
| | | |
① 装置A中反应的化学方程式为________。
② B瓶溶液中H+的主要来源是________。
③ C瓶溶液的溶质是________(填化学式)。
④ 结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因________。
(2)测定C瓶溶液中NaClO含量(单位:g·L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20 mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-==2I-+S4O62-)
① 步骤Ⅰ总反应的离子方程式为_______,盖紧瓶塞并在暗处反应的原因是________。
② C瓶溶液中NaClO的含量为________g·L-1。(保留1位小数。NaClO式量为74.5)
-
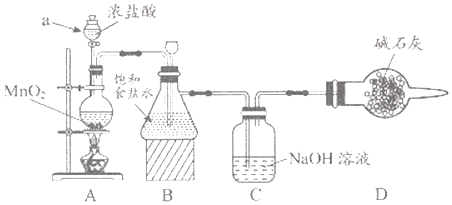
“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
| 实验步骤 | 实验现象 |
| B瓶 | C瓶 |
| 实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
| 实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)
-
“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和 NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
| 实验步骤 | 实验现象 |
| B瓶 | C瓶 |
| 实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
| 实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
-
化学消毒剂在抗击新型冠状病毒肺炎的战役中发挥了重要作用,下列说法错误的是
A.84消毒液与洁厕灵不能混合使用
B.无机含氯消毒剂消毒效果较好,在空气中均比较稳定
C.稀碘伏溶液可用于皮肤消毒
D.来苏水为医院常用消毒剂,其有效成分为酚类
-
2020年新冠肺炎疫情在全球多点爆发。新型冠状病毒对紫外线和热敏感,56℃持续30分钟、酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是( )
A.84消毒液的有效成分是
B.84消毒液与酒精混合使用可增强灭活病毒效果
C.加热能杀死病毒是因为蛋白质受热发生变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
-
2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaC1O2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
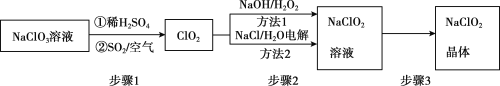
已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaC1O2易分解生成NaC1O3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___,通人空气的作用是___。
(2)方法1中,反应的离子方程式是___,利用方法1制NaC1O2时,温度不能超过20℃,可能的原因是___。
(3)方法2中,NaC1O2在___生成(选填“阴极”或“阳极”)。
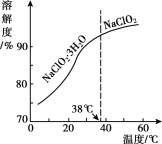
(4)NaC1O2的溶解度曲线如图所示,步骤3中从NaC1O2溶溶液中获得NaC1O2的操作是___。
(5)为测定制得的晶体中NaC1O2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaC1O2的质量分数为___。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是___(用离子方程式和文字表示)。
(6)NaC1O2使用时,加入稀盐酸即可迅速得到C1O2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是___。
-
在 2020 年抗击新型冠状病毒肺炎的战役中,大量防护和消毒用品投入使用,化学品发挥了重要作用,科学防护对预防病毒感染非常重要。下列说法中错误的是
A.聚丙烯和聚四氟乙烯为生产防护服的主要原料,二者均属于有机高分子材料
B.“84” 消毒液、二氧化氯泡腾片可用作环境消毒
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.冠状病毒粒子直径约 60-220 nm, 介于溶液和胶体粒子之间
-
化学在2020年抗击新型冠状病毒肺炎的战役中发挥了巨大作用。下列说法错误的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.防护服、口罩的生产均要用到有机高分子材料
C.过氧化氢、过氧乙酸、84消毒液、二氧化氯泡腾片都可用于环境消毒
D.冷链运输抗病毒疫苗的目的是避免蛋白质变性


=2I-+
)





