-
以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
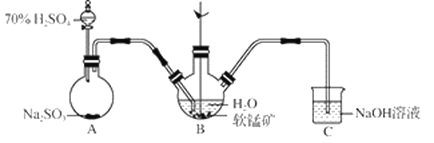
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
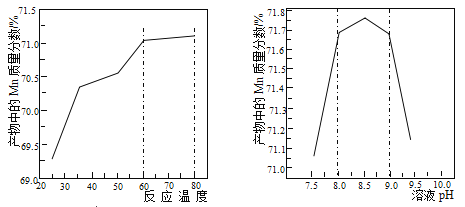
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
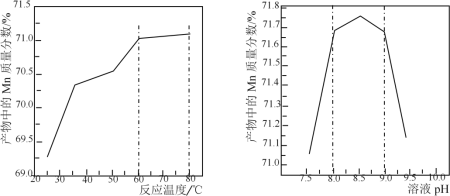
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
-
以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
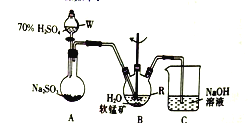
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______。
(2)装置A用于制取SO2,反应的化学方程式为_________。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置C的作用是______________________。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________,用MnCO3调节溶液pH时,需调节溶液pH的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
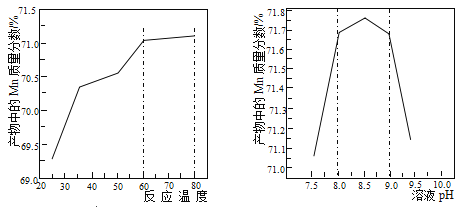
②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________,真空干燥6小时得产品Mn3O4。
-
MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
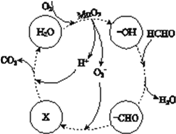
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。
-
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
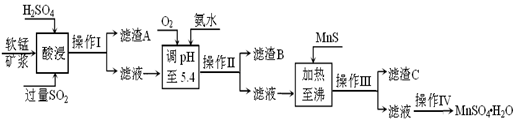
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为________ ________。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 ________ 。
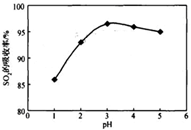
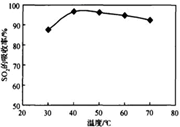
图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是________ ________。
(3)加入MnS的目的是________ ________ ________。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: ________ 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为________(不需计算过程,计算结果保留两位有效数字)。
-
以 、软锰矿(主要成分为
、软锰矿(主要成分为 ,少量
,少量 及
及 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备 液和
液和 ,主要实验步骤如下
,主要实验步骤如下
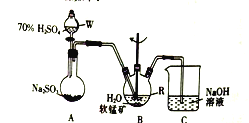
步骤I、如图所示装置,将 通入
通入 中的软锰矿浆液中
中的软锰矿浆液中 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器 中加入适量纯净的
中加入适量纯净的 ,最后加入适量
,最后加入适量 沉铅,
沉铅,
步骤III、过滤得 溶液
溶液
(1)仪器R的名称是_______。
(2)装置 用于制取
用于制取 ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净 的目的是_______________,用
的目的是_______________,用 调节溶液
调节溶液 时,需调节溶液
时,需调节溶液 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的 如下表)
如下表)
| 金属离子 | 
| 
| 
| 
|
| 开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化 浊液可制备
浊液可制备 ,主要副产物为
,主要副产物为 ;反应温度和溶液
;反应温度和溶液 对产品中
对产品中 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示
②反应温度超过 时,
时, 的产率开始降低,
的产率开始降低, 是白色沉淀,
是白色沉淀, 呈黑色;
呈黑色; 、
、 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品 。
。
-
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下:
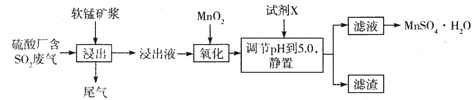
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:

请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
-
用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
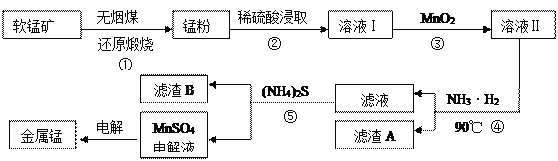
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
-
(12分) 软锰矿(主要成分MnO2,含Fe,Al2O3 ,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息:
室温下几种氢氧化物的溶度积

回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化 L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是 (填标号)。
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是 。
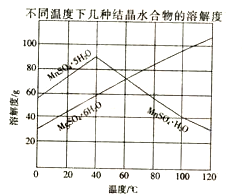
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 。
-
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)纯度为75%的软锰矿17.40g最多能氧化 L(标准状况)SO2.
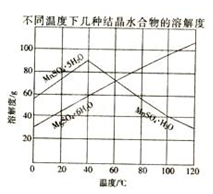
(2)已知:Ksp[Al(OH)3]=1×10﹣33,Ksp[Fe(OH)3]=3×10﹣39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol•L﹣1),需调节溶液pH范围为 .
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,需控制结晶温度范围为 .
(4)准确称取0.1800gMnSO4•H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol•L﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.计算MnSO4•H2O样品的纯度为 %(结果保留两位有效数字)
(5)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。用软锰矿制备K2MnO4的化学方程式是: 。
(6)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
-
(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
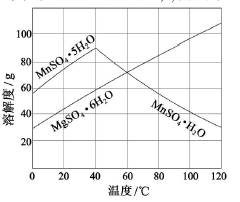
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
(3)右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需
控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)

2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示















