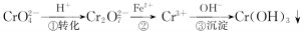-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4∙7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要c(Cr3+)降至10−5mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要c(Cr3+)降至10−5mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要______mol的FeSO4•7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)═Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法,该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为______.
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)______,溶液中同时生成的沉淀还有______.
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要mol的FeSO4·7H2O。
写出第②步中反应的离子方程式_______________________________________________。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.其中一种方法是还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4•7H2O.写出第②步中反应的离子方程式______.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
-
(10分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
A. Cr2O72-和CrO42-的浓度相同 B. 2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
写出第②步中反应的离子方程式____________________________________。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH―(aq)
Cr3+(aq)+3OH―(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.该法的工艺流程为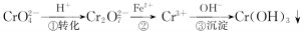
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显____________色.
(2)能说明第①步反应达平衡状态的是________________
a.2v正(Cr2O72-)=v逆(CrO42-)
b.Cr2O72-和CrO42-的浓度相同
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4•7H2O,
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至____________
方法2:电解法.
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为__________
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)____________,溶液中同时生成的沉淀还有_________。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为 。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为 。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
-
(12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
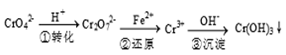
其中第①步存在下列平衡:2CrO42- (黄色) +2H+  Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)∙c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)∙c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。