-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol—1
SO3(g)+NO(g)的ΔH= kJ·mol—1
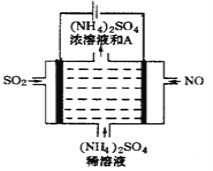
(2)利用反应6NO2+ 8NH3  7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。
7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。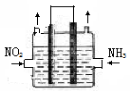
(3)一定条件下,将NO2与SO2以体积比1︰2置于恒容密闭容器中发生下述反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的物质的量比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
(4)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g) CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述
CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述 反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
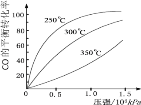
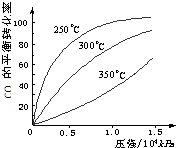
(5)不同温度CO的平衡转化率与压强的关系如上图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
-
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=-Q1kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-Q2kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g) 的△H=______kJ•mol-1.
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,当测得上述反应平衡时NO2与NO体积比为1:3,则平衡常数K=______.
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H______0(填“>”或“<”).
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.
(1)用离子方程式解释Na2C2O4溶液显碱性的原因______;
(2)常温下,比较0.1mol•L-1NaHC2O4溶液中各种离子浓度的大小关系______;
Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a.5ml 水;b.40ml 0.2mol•L-1的Ba(OH)2溶液;c.20ml 0.5mol•L-1的Na2SO4溶液;d.40ml 0.1mol•L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,的浓度由大到小的顺序为______;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为______(设混合溶液的体积为混合前两溶液的体积之和).
-
雾霾天气给人们的出行带来了极大的不便,因此研究NO2、SO2等大气污染物的处理具有重要意义。
(1)某温度下,已知:
①2SO2(g)+O2(g) 2SO3(g) △H1=-196.6kJ/mol
2SO3(g) △H1=-196.6kJ/mol
②2NO(g)+O2(g) 2NO2(g)△H2
2NO2(g)△H2
③NO2(g)+SO2(g) SO3(g)+NO(g) △H3=-41.8kJ/mol
SO3(g)+NO(g) △H3=-41.8kJ/mol
则△H2= _____________。
(2)按投料比2:1把SO2和O2加入到一密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
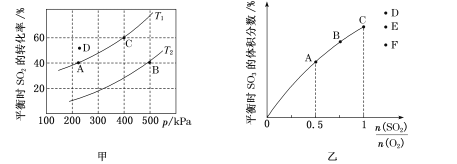
①A、B两点对应的平衡常数大小关系为KA __________(填“>”“<”或“=”,下同)KB;温度为T,时D点vD正与vD逆的大小关系为vD正 _____________vD逆;
②T1温度下平衡常数Kp=______________ kPa-1(Kp为以分压表示的平衡常数,结果保留分数形式)。
(3)恒温恒容下,对于反应2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的体积分数与起始
2SO3(g),测得平衡时SO3的体积分数与起始 的关系如图乙所示,则当
的关系如图乙所示,则当 =1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
=1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
(4)工业上脱硫脱硝还可采用电化学法,其中的一种方法是内电池模式(直接法),烟气中的组分直接在电池液中被吸收及在电极反应中被转化,采用内电池模式将SO2吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入SO2电极的反应式:____________;若40%的硫酸溶液吸收氨气获得(NH4)2SO4的稀溶液,测得常温下,该溶液的pH=5,则 ___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则
___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则 的值将_____(填“变大”“不变”或“变小”)。
的值将_____(填“变大”“不变”或“变小”)。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:Ⅰ.2SO2(g) + O2(g) 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1
Ⅱ.2NO(g) + O2(g)  2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____kJ· mol-1。
SO3(g)+NO(g)的ΔH=____kJ· mol-1。
(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
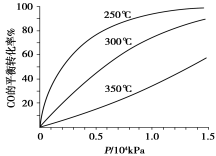
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
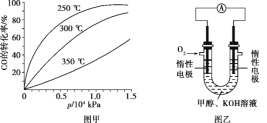
(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向____(填“正”或“负”)极移动。
②该电池正极的电极反应式为___________。
-
(14分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:________。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 ________(写出一种即可)。
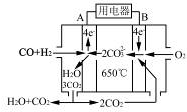
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式________。
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是________。
-
(14分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:________。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 ________(写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式________。
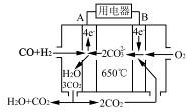
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是________。
-
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g)  2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)  2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)  SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 = (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 = (用K1、K2 表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+ O2(g) 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g)  N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
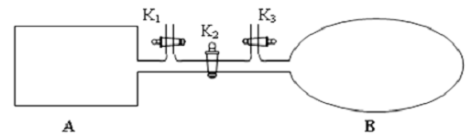
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是 。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa) ﹣1 。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为 。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2 和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
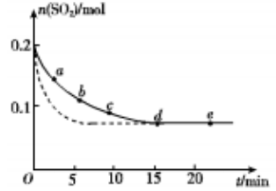
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率 (填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为 。
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图中虚线所示,则改变的条件是 。
-
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g) 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g) 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g) SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 =__________(用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 =__________(用K1、K2表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2通过K1、K3分别充入A、B 中,发生的反应为2NO(g)+ O2(g) 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g) N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
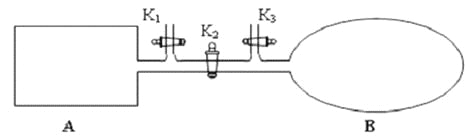
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是_________。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为_____________。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
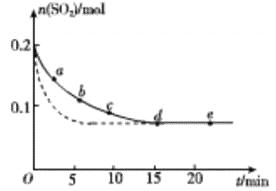
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率____________(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为_________________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如图中虚线所示,则改变的条件是__________。
-
用化学反应原理研究N、S氧化物有着重要的意义。
(1)已知:
2SO2(g)+O2(g)  2SO3(g)ΔH1=-196.6kJ/mol
2SO3(g)ΔH1=-196.6kJ/mol
2NO(g)+O2(g)  2NO2(g)ΔH2=-113.8kJ/mol
2NO2(g)ΔH2=-113.8kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g)ΔH3
SO3(g)+NO(g)ΔH3
则ΔH3=________,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)如下图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2 mol NO和1 mol O2通过K1、K3分别充入A、B中,发生的反应为2NO(g)+O2(g) 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g) N2O4(g)],起始时A、B的体积相同均为a L。
N2O4(g)],起始时A、B的体积相同均为a L。
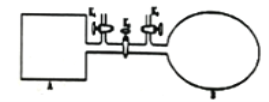
①下列说法和示意图能说明A、B容器均达到平衡状态的是________。
a.A、B容器中气体的颜色均不发生变化
b.A、B容器中NO和O2物质的量浓度比均为2∶1
c.A、B容器中气体的密度不在发生变化
d.A、B容器中气体的平均摩尔质量不再发生变化
e.
②T ℃时,A容器中反应达到平衡时的平衡常数Kp=0.27(kPa)-1。若A容器中反应达到平衡时p(NO2)=200 kPa,则平衡时NO的转化率为________。(Kp是用平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2 L的密闭容器中,测得SO2的物质的量随时间变化如下图实线所示。
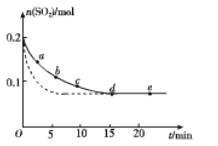
①ab段平均反应速率______________(填“大于”“小于”或“等于”)bc段平均反应速率;de段平均反应速率为________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如上图中虚线所示,则改变的条件是________。
③如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。阴极的电极反应式是_______________。
-
研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g)  N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g)  CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g) 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:

①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
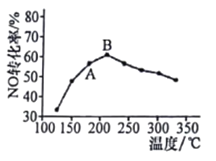
图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
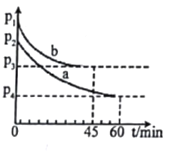
(5)2SO2(g)+O2(g)  2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
 2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)
2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g) 2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)
2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。