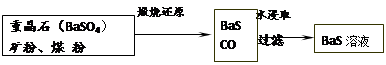-
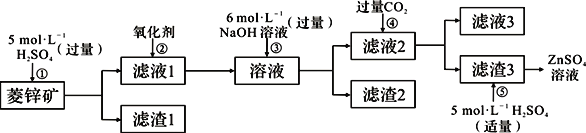
(14分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
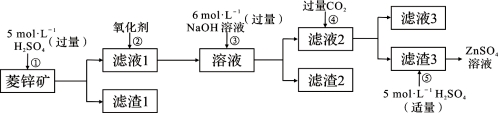
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的 (选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式 。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式: 。
Ⅱ、BaS溶液的制备:
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为: 。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是 。
-
锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的______(填序号),理由是______.
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式:______.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤______产生的______可以用于步骤______(其中步骤选填①、②、③、④、⑤).
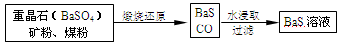
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ•mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
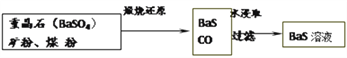
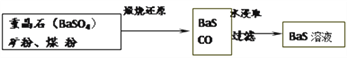
重晶石(BaSo4)矿粉、煤粉 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液
(4)煅烧还原的热化学方程式为:______.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是______.
-
锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
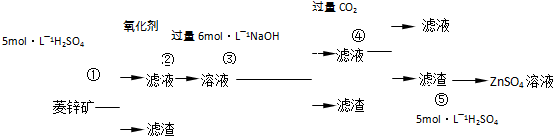
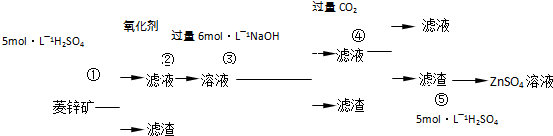
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的______(填序号),理由是______.
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式:______.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤______产生的______可以用于步骤______(其中步骤选填①、②、③、④、⑤).
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ•mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
重晶石(BaSo4)矿粉、煤粉 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液
(4)煅烧还原的热化学方程式为:______.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是______.
-
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
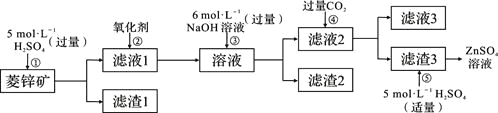
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
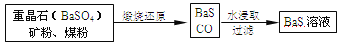
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
-
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4= ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
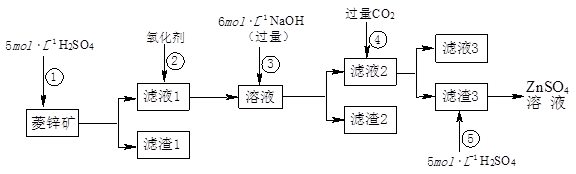
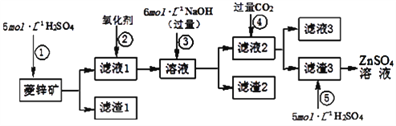
(1)滤渣1的化学式为________;②中使用的氧化剂最好是下列的________(填序号)。
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)滤渣2中主要成分的化学式为________;为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤________(选填①、②、③、⑤)。
(3)步骤④发生的离子反应方程式为________。
II.BaS溶液的制备
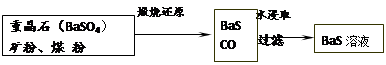
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H1 = -1473.2 kJ•mol-1
C(s)+ 1/2O2(g)=CO(g) △H2 = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s) △H3 = -460 kJ•mol-1
(4)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:
________。
Ⅲ.制取锌钡白
(5)如果Ⅰ中步骤⑤使用硫酸过量,产生的后果是________。
-
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
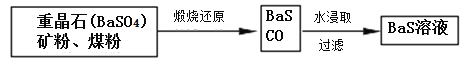
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
-
锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
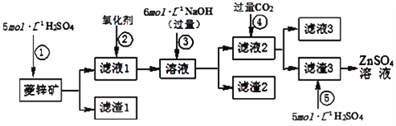
Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备
(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
-
锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备
(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
-
立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
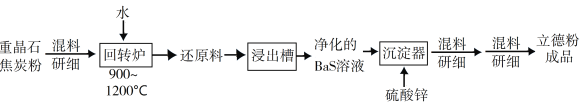
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为____________________________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为_______________________。
②沉淀器中反应的离子方程式为___________________________。
-
立德粉ZnS·BaSO4 (也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为______(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
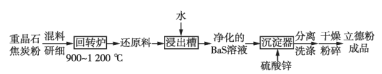
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的______(填化学式)。
③沉淀器中反应的离子方程式为______。


O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1