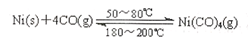-
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)
2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:
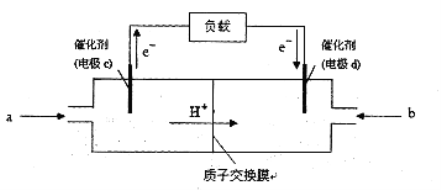
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
(16分)一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;
2CO2(g) △H1=-566.0kJ·mol-1;
S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
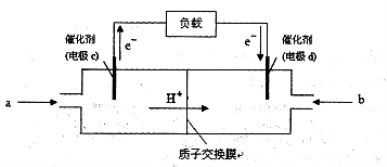
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的____极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
(16分)一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。
已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566.0kJ/mol
②S(s)+ O2(g)=SO2(g)ΔH=-296.0kJ/mol
请写出CO还原SO2的热化学方程式______ 。
(2)工业土用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
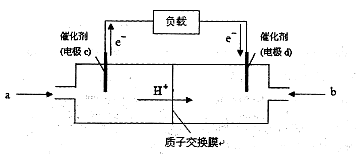
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的___________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:
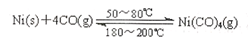

则该反应的△H________0(选填“>” 或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1
CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1
S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1
请写出CO除SO2的热化学方程式________。
 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________。
(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
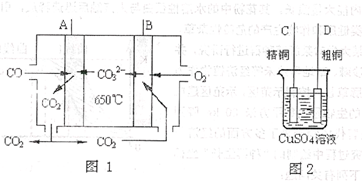
回答下列问题:
①写出A极发生的电极反应式________。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与________极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为________。
-
一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数 ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g)  2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。
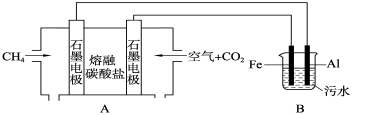
①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
-
一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
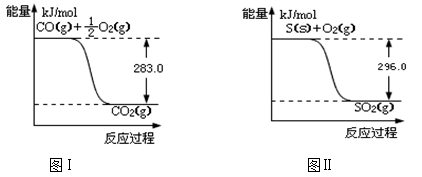
回答下列问题:
(1)SO2(g) + 2CO(g)  S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。
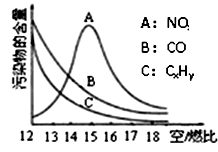
已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
-
一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
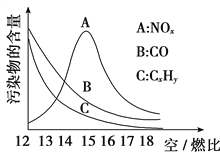
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
-
乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g) 2
2 (g) △H1=-206.6kJ•mo1-1
(g) △H1=-206.6kJ•mo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ•g-1,则△H3=___kJ•mol-1
(3)实验测得2CH2=CH2(g)+O2(g) 2
2 (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2( ),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___, =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+ O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
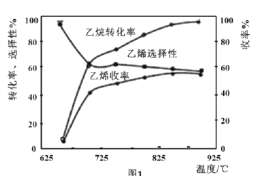
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
-
乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g) 2
2 (g) △H1=-206.6kJ•mo1-1
(g) △H1=-206.6kJ•mo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ•g-1,则△H3=___kJ•mol-1
(3)实验测得2CH2=CH2(g)+O2(g) 2
2 (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2( ),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___, =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+ O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJ•mol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
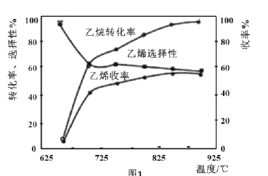
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
-
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。 Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
下列说法正确的是
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);