-
(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式 。
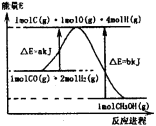
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L—l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300 ℃时反应开始10分钟内,H2的平均反应速率为 ;
②500 ℃时平衡常数K的数值为 ;
③300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (选填编号)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 减小
减小
(3)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
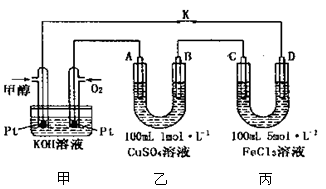
①甲中负极的电极反应式为 ;
②乙中A极析出的气体在标准状况下的体积为 ;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL5.0 mol•L—lNaOH 溶液。
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
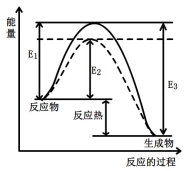
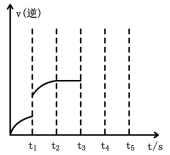
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
-
(6分)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
⑴ 比较此时正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”)。
⑵ 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =________mol·(L·min)-1。
⑶ 生产过程中,合成气要进行循环,其目的是________。
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
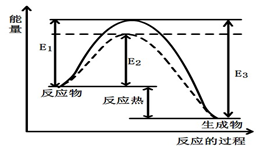
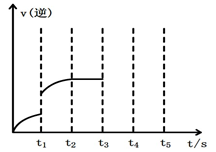
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式________
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是________。
(3)判断反应达到平衡状态的依据是________(填字母序号)。
A.2v(H2)(逆) =v(CO)(正) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为________。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是________(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为________。

-
(10分)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是_____________。
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
(2)乙醇燃料电池具有很高的实用价值。下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应式为________。
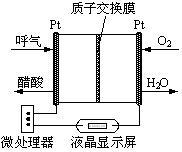
(3)已知:CO(g)+1/2 O2(g)=CO2(g);△H2=-283 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为
________
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:
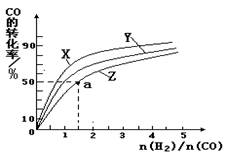
①在上述三种温度中,曲线Z对应是________。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K =________。
CH3OH(g) 的平衡常数K =________。
-
(10分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________0。(填“>、<或=”下同)
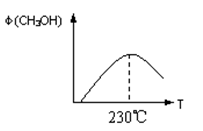
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的________倍。
(3)利用甲醇燃料电池设计如图所示的装置:
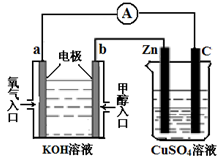
①则该装置中b为________极,写出装置中电解池内发生反应的离子方程式 ________,
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为________L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)== C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)== C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式________。
-
(10分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________
CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________
________0(填“>、< 或 = ”)
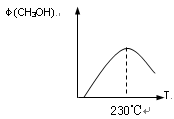
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K________1 (填“>、< 或 = ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的________倍。
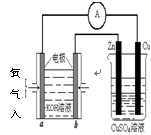
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为________极。
①写出b极的电极反应式 ________。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为________L。
-
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g)  CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
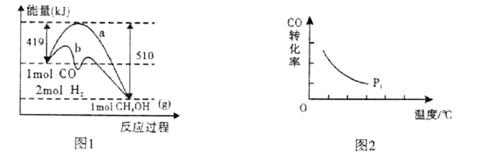
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol•L-1 | 等质量催化剂的 比表面积/m2•g-1 |
| CO | H2 |
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | ________ | ________ | 124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2 > p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
-
(10分)甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2  CH3OH
CH3OH
图1表示该反应进行过程中的能量变化:

图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的________倍;改变下列条件,能提高CO转化率的是________。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的________倍;改变下列条件,能提高CO转化率的是________。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:
c(HCOO-)<c(Na+)时,则反应的情况可能为。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量
-
甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。
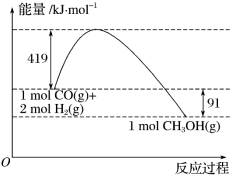
②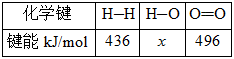
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。
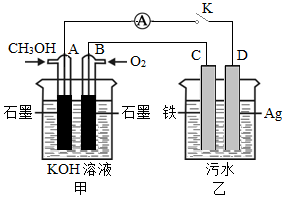
①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
CH3OH(g)

减小
















