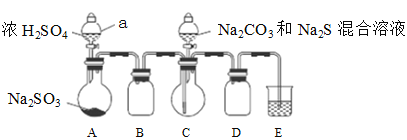
-
1869年,俄国化学家门捷列夫绘制出了第一张元素周期表,下列说法正确的是( )
A. 元素周期表中所有的金属元素都在过渡金属区域
B. 含有元素种类最多的族是第IIIB族
C. 所有长周期中都含有18种元素
D. 元素周期表中所有的非金属元素都分布在右上角
难度: 简单查看答案及解析
-
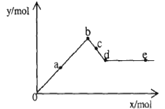
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法中不正确的是
X
Y
Z
A. X、Y、Z形成的单质中,Z的单质熔点最高
B. Y所在周期中所有主族元素,Y的原子半径最小
C. Z所在族中元素的最高正价均为+6价
D. 能发生Cl2+H2Z=Z↓+2HCl的反应,说明非金属性C1>Z
难度: 简单查看答案及解析
-
下列有关说法正确的是 ( )
A. 1mol NaCl分子中含有1mol Na+和1mol Cl-
B. 离子化合物和共价化合物溶于水都能导电
C. 离子键的形成一定有电子的得失
D. KOH溶于水电离出K+ 和OH- 不是化学变化
难度: 简单查看答案及解析
-
鉴别NaCl、NaBr、NaI可以选用的试剂是 ( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯
A. ①②④ B. ②③ C. ②④⑤ D. ④⑤
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是 ( )
选项
事实
推测
A
CaCO3和Ba CO3都难溶于水
SrCO3也难溶于水
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 有H、D、T与16O、17O、18O相互结合为水,可得水分子18种,相对分子质量不同的水分子种数为8种
B. H2、D2、T2互为同素异形体
C. H2、D2、T2在相同条件下的密度比为1∶2∶3
D. 氕、氘发生核聚变成其它元素,属于化学变化
难度: 中等查看答案及解析
-
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤氧化物与水反应都不会再生成气体
A. 全部 B. 只有① C. 只有①②③ D. 只有①②④⑤
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. 化学反应的实质是旧键的断裂,新键的生成
B. CH4、CF4、CCl4、CBr4熔沸点逐渐升高,原因是分子间作用力逐渐增大
C. NH3和H2O间可以形成氢键,这也是氨极易溶于水的原因之一
D. NH4H中含有离子键、极性键、非极性键
难度: 简单查看答案及解析
-
运用元素周期律分析下面推断,其中错误的是( )
①Be的氧化物对应的水化物可能具有两性 ②Tl元素既能与盐酸反应又能跟烧碱反应 ③At2 为有色固体,HAt 不稳定,AgAt 感光性很强,但不溶于水也不溶于酸 ④Li在氧气中剧烈燃烧,产物是Li2O2,LiOH是一种强碱 ⑤Rb与水反应很剧烈 ⑥硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
A. ①②③④ B. ②④⑥ C. ①③⑤ D. ②④⑤
难度: 中等查看答案及解析
-
工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁: 海水
Mg(OH)2
MgO
Mg
B. 冶炼铝: 铝土矿
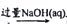 NaAlO2
NaAlO2无水AlCl3
Al
C. 制溴: 浓缩海水
Br2
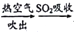 HBr(aq)
HBr(aq) 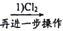 Br2
Br2D. 制碘: 海带
海带灰
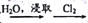 I2(aq)
I2(aq)  I2
I2难度: 中等查看答案及解析
-
化学与生产生活息息相关,下列说法正确的有几项( )
①明矾可以用作净水剂,杀菌消毒 ②SiO2用途广泛,以SiO2为主要成分的沙子仍是基本的建筑材料,纯净的SiO2是现代光学及光纤制品的基本原料 ③硅酸钠的水溶液可以做木材防火剂 ④考古时利用14C测定文物年代,2H和3H用于制造氢弹 ⑤在周期表金属与非金属的分界处,可以找到半导体材料,在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 ⑥海水中的碘是以I2的形式存在于海带中 ⑦丁达尔效应是由于光的衍射形成的 ⑧王水是浓硝酸和浓盐酸的混合物(体积比是3:1)
A. 3项 B. 4项 C. 5项 D. 6项
难度: 中等查看答案及解析
-
将一定质量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1—m2为( )
A. 5.76 B. 2.88 C. 1.92 D. 无法计算
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是 ( )
A. 2 4 3 2 2 6 B. 0 2 1 0 1 2
C. 2 0 1 2 0 2 D. 2 2 2 2 1 4
难度: 中等查看答案及解析