-
2012年4月22日是第43个“世界地球日”,其主题为“绿色梦想,低碳行动”。下列做法符合这一主题的是
①开发太阳能、风能和氢能等能源;②大量开采地下水,以满足生产、生活的需求;③在含硫的煤中加入适量生石灰;④利用苯、甲苯等有机物代替水作溶剂;⑤利用可降解的“玉米塑料”生产一次性饭盒。
A.①③⑤ B.①②③ C.②④⑤ D.①②④
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.含18个中子的氯原子的核素符号:
Cl
B.NaHCO3的电离方程式:NaHCO3=Na++H++CO32—
C.1-丙醇的结构简式:C3H7OH
D.CO(NH2)2的电子式:
难度: 简单查看答案及解析
-
下列物质的用途错误的是
A.用动物毛皮作原料生产氨基酸 B.用SO2熏蒸粉丝等食品使其增白
C.用水玻璃可生产硅胶、防火剂等 D.用浸泡过KMnO4溶液的硅土保鲜水果
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42-
B.加入铝粉放出H2的溶液中:Al3+、K+、SO42—、Cl—
C.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
D.水电离产生的c(OH—)=10—12 mol·L—1的溶液中:K+、Mg2+、SO42—、NO3—
难度: 简单查看答案及解析
-
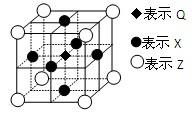
短周期主族元素X、Y、Z最外层电子数之和为11,它们在周期表中的相对位置如下图所示。下列关于X、Y、Z元素的说法正确的是
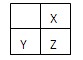
A.X、Z的高价态氧化物性质相似
B.工业上常用电解法生产Y的单质
C.原子半径的大小顺序为rX<rY<rZ
D.元素X的最高价氧化物对应的水化物的酸性比Z的弱
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.用铜为电极电解饱和食盐水:2Cl—+2H2O
Cl2↑+H2↑+2OH—
C.在明矾溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
D.小苏打溶液中加少量Ba(OH)2溶液:2HCO3—+Ba2++2OH—=BaCO3↓+2H2O+CO32—
难度: 简单查看答案及解析
-
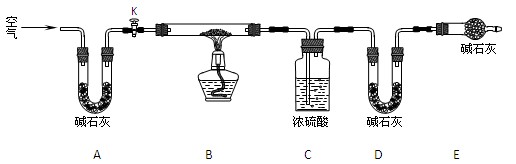
下列有关实验装置的说法中正确的是
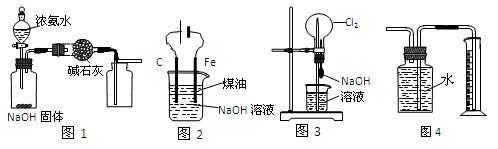
A.用图1装置制取干燥纯净的NH3
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L0.1mol·L—1的氨水中含有的NH3分子数为0.1NA
B.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
C.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA
D.常温常压下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.2NA
难度: 简单查看答案及解析
-
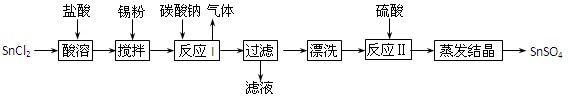
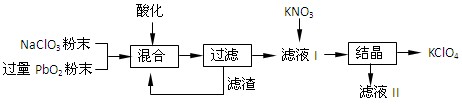
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
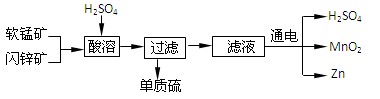
下列说法正确的是
A.酸溶时,MnO2作还原剂 B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用 D.在电解池的阴极处产生MnO2
难度: 简单查看答案及解析
-
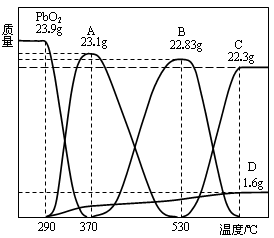
向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是
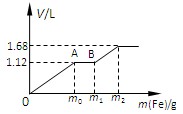
A.开始时产生的气体为H2
B.AB段发生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 mol·L—1
D.参加反应铁粉的总质量m2=5.6g
难度: 简单查看答案及解析
-
2011国际化学年瑞士发行了一枚印有维生素C(只含C、H、O三种元素)分子球棍模型的邮票,以纪念化学家Reichstein1933年首先合成维生素C。下列关于维生素C的说法正确的是

A.维生素C的分子式C6H10O6
B.维生素C不能使酸性高锰酸钾褪色
C.维生素C分子含有两个手性碳原子
D.1mol维生素C与足量的钠反应能产生2molH2
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g) + B(g) = 3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0
难度: 简单查看答案及解析
-
下列有关实验操作、实验结论和说法正确的是
A.粗略配制浓度为2 mol·L—1的NaCl溶液,可将58.5gNaCl加入到盛有500mL水的烧杯中,搅拌、溶解
B.将滴定管洗净,再用蒸馏水润洗后,即可注入标准液进行滴定
C.向乙酸乙酯中加入稀NaOH溶液,振荡,分液,可除去乙酸乙酯中的少量乙酸
D.为验证氯仿中含有的氯元素,可向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3,观察到白色沉淀
难度: 简单查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—)
B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH―)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-c(OH-)
D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:
c(Na+)=c(CH3COO-)+c(CH3COOH)
难度: 简单查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
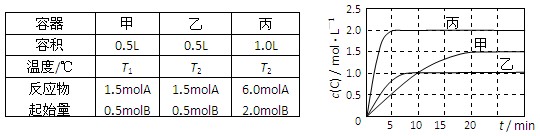
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
难度: 简单查看答案及解析