-
下列判断哪些是正确的
①氢氧化钠是电解质
②强电解质溶液的导电性一定比弱电解质溶液导电性强
③氯化银难溶于水,所以氯化银是非电解质
④蔗糖易溶于水,所以是电解质
⑤氯气溶于水后导电,所以Cl2是电解质
A、① B、①③ C、①④⑤ D、①②③⑤
难度: 简单查看答案及解析
-
下列有关反应限度的叙述正确的是
A、大多数化学反应在一定条件下都有一定的限度
B、依据焓判据:NH4HCO3受热分解可自发进行
C、使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
D、FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深
难度: 简单查看答案及解析
-
下列叙述正确的是
A、明矾是常用的净水剂,可以杀菌消毒。
B、分别向澄清石灰水溶液、氯化钙和偏铝酸溶液通入二氧化碳气体过程中都有白色沉淀产生。
C、CaCO3难溶于水而Ca(HCO3)2易溶于水,可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
D、NaOH溶液可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液。
难度: 简单查看答案及解析
-
下列关于铜电极的叙述正确的是
A、铜锌原电池中铜电极上发生氧化反应
B、电解饱和食盐水制烧碱时,用铜作阳极
C、电解法精炼铜时,粗铜连接电源的正极
D、电镀铜和精炼铜时,均用纯铜作阴极
难度: 简单查看答案及解析
-
常温下,下列物质的水溶液,其pH小于7的是
A、Na2CO3 B、NH4NO3 C、Na2SO4 D、KNO3
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7;②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体⑥HF能溶于水
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A、①②⑦ B、②③⑤ C、③④⑥ D、①④
难度: 简单查看答案及解析
-
下列各电离方程式中书写正确的是
A、CH3COOH==H++CH3COO-
B、CO32-+2H2O
H2CO3+2OH-
C、H++A1O2-+H2O
Al(OH)3
Al3++30H-
D、NaH2PO4
Na++H2PO4-
难度: 简单查看答案及解析
-
在100mL0.1mol/L的醋酸溶液中,欲使醋酸的电离程度增大,时浓度减小,可采用的方法是
A、加热 B、加入lmol/L的醋酸溶液l00mL
C、加入少量的0.5mol/L的硫酸 D、加入少量的lmol/L的NaOH溶液
难度: 简单查看答案及解析
-
25OC时,水的电离平衡:H2OH++OH-
H>0,下列叙述正确的是
A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C、向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D、将水加热,Kw增大,c(H+)不变
难度: 简单查看答案及解析
-
向某无色透明溶液中加入铝片,立刻有大量氢气产生,则下列离子在该溶液中一定不会大量存在的是
A、Na+ B、NO3- C、CO32- D、HCO3-
难度: 简单查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是
A、pH=4的盐酸和pH=10的氨水等体积混合
B、pH=2的盐酸和pH=13的氢氧化钡等体积混合
C、pH=5的醋酸和pH=9的氢氧化钡等体积混合
D、pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况
A、CuSO4 B、CuO C、Cu(OH)2 D、CuSO4
5H2O
难度: 简单查看答案及解析
-
根据下列事实:(1)X+Y2+===X2++Y;(2)Z+2H2O====Z(OH)2+H2
(3)Z2+氧化性比X2+弱;(4)由Y、W电极组成的原电池,电极反应为:W2++2e-===W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
A、X>Z>Y>W B、Z>W>X>Y
C、Z>X>Y>W D、Z>Y>X>W
难度: 简单查看答案及解析
-
金属镍有广泛应用。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
A、阳极发生还原反应,其主要电极反应式:Ni2++2e- ==== Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D、电解后,电解槽底部的阳极泥中含有Cu和Pt
难度: 简单查看答案及解析
-
已知25OC时,电离常数Ka(HF)=3.6
10-4 mol
L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3
L-3。现向1L0.2 mol
L-1HF溶液中加入1L0.2 mol
L-1CaCl2溶液,
则下列说法中,正确的是
A、25oC时,0.1 mol
L-1HF溶液中pH=1 B、Ksp(CaF2)随温度和浓度的变化而变化
C、该体系中Ksp(CaF2)=
D、该体系中有CaF2沉淀产生
难度: 简单查看答案及解析
-
下列叙述正确的是
A、pH=3的酸溶液稀释l00倍后pH=5
B、相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍
C、相同温度相同浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH
D、碳酸钠溶液在室温时的pH一定大于60℃时的pH
难度: 简单查看答案及解析
-
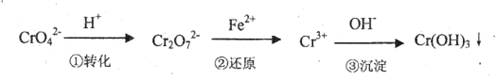
按图示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为
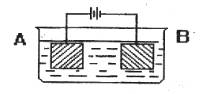
A、4:1 B、3:1 C、2:1 D、任意比
难度: 简单查看答案及解析
-
为了使带Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是
A、适量的盐酸 B、适量的NaOH溶液
C、适量的FeCl2溶液 D、适量的Na2S固体
难度: 简单查看答案及解析
-
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-②HB-
H++B2-③HB-+H2O
H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、H2B为弱电解质 D、HB-的电离程度小于HB-的水解程度
难度: 简单查看答案及解析
-
下列各溶液中,相关微粒物质的量浓度关系不正确的是
A、0.1 mol·L-1NH3·H2O溶液中:c(NH4+)<c(OH-)
B、0.1 mol·L-1NH4C1溶液中:c(NH4+)+c(H+)==c(Cl-)+c(OH-)
C、0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+c(H2CO3)=0.1 mol·L-1
D、浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4,NH4HSO4溶液,c(NH4+)大小顺序:
CH3COONH4>NH4Cl>NH4HSO4
难度: 简单查看答案及解析
-
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是
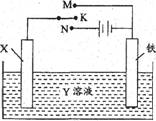
A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
难度: 简单查看答案及解析