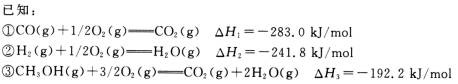-
化学与社会、生活密切相关,下列说法正确的是
A.凡含有食品添加剂的食物对人体健康均有害,不可食用
B.在食品袋中放入盛有硅胶的透气小袋,可防止食物氧化变质
C.Fe2O3俗称铁红,常做红色油漆和涂料[
D.工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A.1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
B.将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
C.
标准状况下,22.4 L氮
气与22.4 L苯所含分子数均为 NA
D.常温常压下,32gO2、O3的混合物含有2Na个氧原子
难度: 中等查看答案及解析
-
“类推”这种思维方法在化学学习与研究中有时会产生错误结
论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
A.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
B.Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解
C.Na可与冷水反应产生氢气,K也可与冷水反应生成氢气
D.CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞显红色的溶液:Na+、Fe3+、NO3-、Cl-
B.0.1 mol·L-1氨水溶液:K+、Na+、NO3-、AlO2-
C.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
D.水电离出的c(H+)浓度为10-12的溶液:Ca2+、NH4+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列反应的离子方程式表示正确的是
A.用惰性电极电解NaCl溶液2H2O+2Cl-
Cl2↑+H2↑+2OH-
B.铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+
C.用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O =2Cr3++6Fe3++14OH-
D.Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
难度: 中等查看答案及解析
-
分子式为C5H12O且不与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
难度: 中等查看答案及解析
-
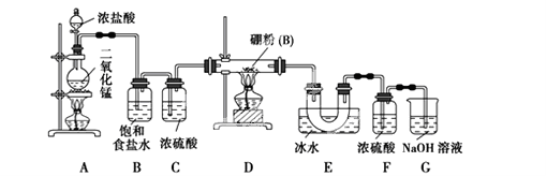
下列装置或操作能达到实验目的的是
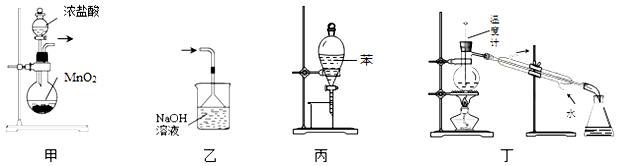
A.用装置甲制取氯气 B.用乙装置除去氯气中的HCl气体
C.用丙装置萃取溴水中的溴单质 D.用丁装置分离乙酸与乙醇
难度: 中等查看答案及解析
-
下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图。下列说法正确的是

A. CO、SO2、SO3均
是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上用氯气和石灰乳制取漂白粉的反应中原子利用率为100%
D.严禁用工业酒精勾兑饮用酒是因为工业酒精中含有有毒的甲醇
难度: 中等查看答案及解析
-
CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已
知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为3mol•L-1,则此溶液最多溶解铁粉的质量为
A.5.6g B.11.2g C.22.4g D.33.6g
难度: 困难查看答案及解析
-
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是
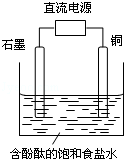
A.铜是电解池的阳极
B.石墨电极附近溶液呈红色
C.铜电极上产生的是无色气体
D.石墨电极上发生还原反应
难度: 中等查看答案及解析
-
五种短周期主族元素A、B、C、D、E的原子序数依次增大,A2属于绿色燃料,C的氧化物用于生产光导纤维,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是
A. 五种元素中有两种金属元素
B. 元素C、D、E的最高价氧化物对应水化物的酸性增强
C. 元素D、E分别与元素A形成化合物的稳定性:A2D>AE
D. 元素B、D、E的简单离子半径大小为:B>D>E
难度: 中等查看答案及解析
-
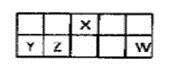
有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置


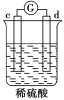

实验现象
a极质量减小,
b极质量增加
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.a>b>d>c D.d>a>b>c
难度: 中等查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
难度: 中等查看答案及解析
-
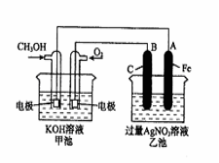
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电
时的总反应式为3Zn +2K2FeO4+8H2O =3Zn(OH)2 +2Fe(OH)3 +4KOH。下列叙述正确的是
A.放电时,正极区溶液的pH增大
B.放电时,负极反应式为3Zn-6e-= 3Zn2+
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
难度: 困难查看答案及解析