-
化学与生活密切相关,下列说法错误的是
A. 蔗糖可作调味剂
B. 瓷器的重要成分是硅酸盐
C. 维生素D可促进人体对钙的吸收
D. 可溶性的铝盐和铁盐能用于饮用水消毒杀菌
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A. NH3可用作制冷剂 B. 过氧化氢有氧化性,不能用于人体消毒
C. S的氧化性比Cl2 的氧化性强 D. 电解饱和食盐水制备金属钠
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 质量数为31的磷原子:
B. 氟离子的结构示意图:
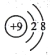
C.
和
的核外电子数不同 D. 乙酸乙酯的结构简式:C4H8O2
难度: 简单查看答案及解析
-
人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是( )
A. 亚硝酸盐被还原 B. 维生素C是还原剂
C. 维生素C将Fe3+还原为Fe2+ D. 亚硝酸盐与一氧化碳使人中毒的原理相同
难度: 简单查看答案及解析
-
甲烷、乙烯、乙醇、乙酸都是常见的有机物,下列说法正确的是
A. 甲烷中混有乙烯,用酸性高锰酸钾溶液除去
B. 乙醇不能使酸性高锰酸钾溶液褪色
C. 酒越陈越香与酯化反应有关
D. 乙醇与乙酸酯化反应时用稀硫酸作催化剂
难度: 简单查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质,如下图所示。下列说法正确的是
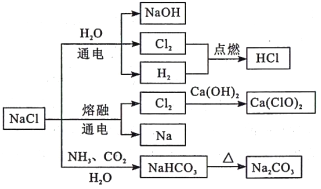
A. 石灰乳与Cl2的反应中,Cl2既是氧化剂又是还原剂
B. 25℃时,NaHCO3 在水中的溶解度比Na2CO3 大
C. Cl2与过量的铁反应生成FeCl2
D. 图示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 46g乙醇中存在的共价键总数为7NA
B. 1molFeI2与足量氯气反应时转移的电子数为2NA
C. 标准状况下,1L0.1mol/L氨水中含有0.1NA个NH3分子
D. 标准状况下,18g水含有NA个H2O分子
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质的质量不变的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将铁钉投入Cu(NO3)2溶液
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A. 铁红(Fe203)溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B. 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+
C. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3-=BaCO3↓+H2O
D. 成分为盐酸的洁厕灵与“84”消毒液混合使用易中毒:C10-+H+=HCl0
难度: 中等查看答案及解析
-
锂离子电池电极材料钛酸锂Li2Ti5O15含有过氧键(O-O),该化合物中Ti的化合价为+4,则Li2Ti5O15中过氧键的数目为
A. 2个 B. 4个 C. 6个 D. 8个
难度: 中等查看答案及解析
-
(SCN)2称为拟卤素,将几滴KSCN溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中一份溶液中加人适量KMnO4溶液,红色褪去;②向另一份溶液中通入SO2,红色也褪去。下列说法中不正确的是
A. Fe3+与SCN-反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3
B. ②中红色褪去的原因是SO2将SCN-还原
C. ①中现象说明SCN-与Cl-相似,有还原性
D. SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,乙的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A. 原子半径的大小顺序为:Z>W>X>Y
B. 元素X的气态氢化物与其最高价氧化物的水化物能发生反应
C. 离子半径大小顺序为:Y>Z
D. 由X元素与Y元素组成的物质中一定含有离子键
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是
A. 稀盐酸可除去烧瓶内残留的MnO2
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH
D. 盛放氯水应用带橡胶塞的细口玻璃瓶
难度: 简单查看答案及解析
-
科学家首次用X射线微光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
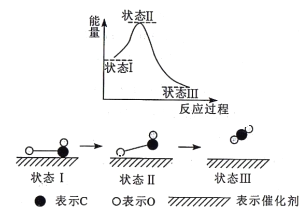
下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,既有旧化学键的断裂又有新化学键的形成
C. CO和O生成了具有极性共价键的CO2
D. 该过程表示CO、O和催化剂的能量之和大于CO2的能量
难度: 简单查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
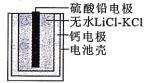
A. Ca为正极 B. 放电过程中,Li+向负极移动
C. 每转移0.2mol电子,理论上生成20.7gPb D. 电池工作一段时间后,正极质量增大
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,发生反应:2NO2(g)
N2O4(g)。下列说法正确的是
A. 混合气体平均相对分子质量不变时,反应达到平衡状态
B. 达到平衡后,两种物质的浓度之比为2:1
C. 升高温度,平衡状态不改变
D. 若平衡后压强是开始的0.8倍,则转化率为20%
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
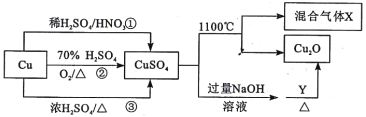
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③
C. 硫酸铜在1100℃分解的方程式为:2CuSO4
Cu2O+SO2↑+SO3↑+O2↑
D. 当Y为葡萄糖时,葡萄糖发生还原反应
难度: 中等查看答案及解析
-
某澄清、透明的浅黄色溶液中可能含有H+、NH4+、Fe3+、Ba2+、Al3+、HCO3-、I-、SO42-八种离子中的几种,在设计检验方案时,一定不需要检验的离子是
A. H+、NH4+、Fe3+ B. HCO3-、I-、Ba2+
C. SO42-、Al3+、I- D. NH4+、Ba2+、Al3+
难度: 中等查看答案及解析