-
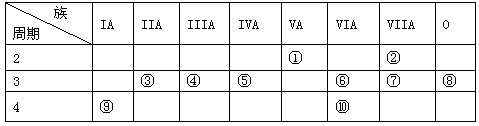
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.在化学反应中,原子首先失去的电子能量最低
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
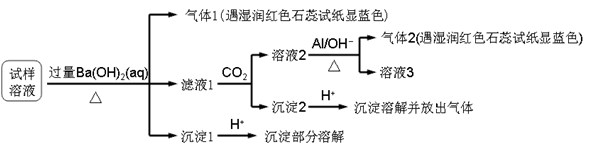
已知:3NO3- + 8Al + 5OH- + 2H2O
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
难度: 困难查看答案及解析
-
下列说法错误的是(NA表示阿伏伽德罗常数的值)
A.NA个Fe原子的质量为56g,则1个Fe原子的质量为
g
B.20℃时,铝的密度为2.7g·cm-3,则1个Al原子的体积为
cm3
C.4℃时,水的密度为1.0g·cm-3,则1个H2O分子的体积为
cm3
D.标准状况下,NA个N2分子所占的体积约为22.4L,则1个N2分子的体积为
L
难度: 中等查看答案及解析
-
下列有关离子方程式书写正确的是
A.Fe(NO3)3溶液中加入少量的HI溶液:2Fe3++2I-=2Fe2++I2
B.向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
C.用惰性电极电解饱和食盐水:2Cl-+2H+
H2↑+Cl2↑
D.向苯酚钠溶液中通入少量的CO2:2C6H5O--+CO2 +H2O=2C6H5OH+CO32-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
B.在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C.标准状况下,11.2 L的SO3所含分子数为0.5NA
D.室温下,8 g甲烷含有共价键数为2NA
难度: 中等查看答案及解析
-
某元素原子的最外层电子数为次层电子数的3倍,则该元素原子核内质子数为
A.3 B.7 C.8 D.10
难度: 中等查看答案及解析
-
下列说法中正确的是
A.已知:2H2O(l)= 2H2(g)+O2(g);△H1>0H2O(l)=H2(g)+1/2 O2(g);△H2>0 则△H1>△H2
B.在合成氨工业生产中,为提高氢气的转化率,可采取使用催化剂的措施
C.因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
D.热量可能自发地从低温物体传递到高温物体
难度: 中等查看答案及解析
-
某温度下,对于反应N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ/mol。
N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是:

A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B.平衡状态由A变到B时,平衡常数K(A) < K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
难度: 困难查看答案及解析
-
下列关于有机物
 的叙述不正确的是
的叙述不正确的是A.分子式为C6H10O
B.可发生加成、酯化和氧化反应
C.分子中有两种官能团
D.与HBr、溴水发生加成反应,产物都只有一种
难度: 中等查看答案及解析
-
溴化碘(IBr)的化学性质类似于卤素单质,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,与水反应的化学方程式为IBr+H2O====HBr+HIO,则下列关于IBr的叙述不正确的是
A.IBr是共价化合物
B.IBr在很多反应中是强氧化剂
C.IBr跟H2O反应时既不是氧化剂也不是还原剂
D.IBr跟NaOH溶液反应生成NaBrO、NaI和H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4,
B.可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
C.实验室保存少量液溴和白磷常用水封
D.浓碱溶液沾到了皮肤上要立即用盐酸冲洗
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.铁与足量稀硝酸反应,1 mol Fe失去电子数为2 NA
B.常温常压下,22.4L 乙烯中含极性共价键数目为5 NA
C.1 L 1 mol·L-1的NH4Cl中有NA个NH4+
D.46 g NO2 和 N2O4混合气体中含有原子数为3NA
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
难度: 中等查看答案及解析
-
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
A.通入氯气 B.加入Zn C.加入Fe D.加入Cu
难度: 中等查看答案及解析
-
可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是
A.银氨溶液 B.新制氢氧化铜悬浊液
C.石蕊试液 D.碳酸钠溶液
难度: 中等查看答案及解析
-
用光洁的铂丝蘸取某无色溶液,在无色灯焰中灼烧时,观察到黄色火焰,下列有关叙述中正确的是
A.只有Na+ B.一定含Na+,也可能含K +
C.既有Na+又有K+ D.可能含Na+,也可能含K +
难度: 中等查看答案及解析
-
已知—COOH能电离出—COO-和H+,—NH2能和H+结合生成—
。当把晶体丙氨酸溶于水,处于电离平衡状态时,并使溶液呈强碱性,则存在最多的粒子是
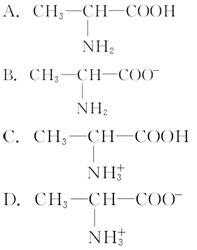
难度: 中等查看答案及解析
-
在0℃和101 kPa的条件下,将4.00 g Ar、1.40 g N2和 1.60 g O2混合,该混合气体的密度是相同条件下氢气密度的
A.35倍 B.17.5倍 C.7倍 D.14倍
难度: 中等查看答案及解析
-
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是
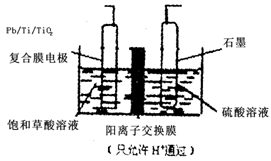
A.电解时石墨电极应与直流电的正极相连
B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O
C.电解时石墨电极上有O2放出
D.电解一段时间后,硫酸溶液的pH不变化
难度: 困难查看答案及解析
-
烧瓶中放入铜片和稀硝酸,用酒精灯加热来制取较纯净的一氧化氮,反应开始后发现烧瓶中充满红棕色气体,这时的操作应是
A.立即接收集容器,用向上排空气法收集
B.待烧瓶中红棕色气体消失后,用向上排空气法收集
C.待烧瓶中红棕色气体消失后,用排水法收集
D.立即用排水法收集
难度: 中等查看答案及解析
-
下列实验操作及现象与实验结论都正确且有因果关系的是
选项
实验操作及现象
实验结论
A
分别点燃乙烯和乙炔,乙炔产生的黑烟更浓
乙炔的含碳量高于乙烯
B
在滴有酚酞的Na2CO3溶液中加入BaCl2溶液后红色褪去
BaCl2溶液呈酸性
C
分别取绿豆大的钾和钠,用滤纸吸干表面的煤油,投入盛水的烧杯中,钾反应更剧烈
钾的金属性比钠强
D
测定相同浓度的盐酸和磷酸溶液的pH:盐酸的pH较小
氯的非金属性比磷强
难度: 中等查看答案及解析
-
下列说法合理的是
A.增加反应物的用量,化学反应速率一定加快
B.在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
C.难溶物A、B,KSP(A)>KSP(B),则溶解度S(A)>S(B)
D.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为碳酸钠
难度: 中等查看答案及解析
-
关于下列各实验或装置的叙述中,正确的是
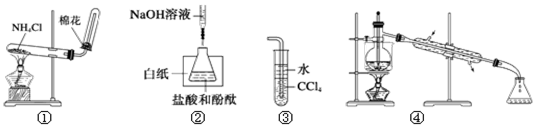
A.实验①可用于制取氨气
B.实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点
C.装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸
D.装置④可用于从酒精水溶液中制取无水乙醇
难度: 中等查看答案及解析
-
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,不一定得到金属的单质
C.氧化还原反应的特征是有元素电子的转移(得失或偏移)
D.某元素在化学反应中由化合态变为游离态,该元素可能被氧化也可能被还原
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法错误的是
A.在标准状况下22.4L H2中含有氢分子的个数为2NA
B.24g Mg变为Mg2+时失去的电子数为2NA
C.32g O2中含有氧原子的个数为2NA
D.1L 1mol/L NaCl溶液中含有钠离子的个数为NA
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.原子半径的大小顺序: Y<Z<W<X
B.化合物YX、ZX2、WX3中化学键的类型相同
C.非金属性的强弱顺序:X>W>Z
D.元素W的最高价氧化物对应水化物的酸性比Z的弱
难度: 中等查看答案及解析
-
已知X、Y是第三周期的非金属元素,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物中,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X强于Y
D.气态氢化物的稳定性:HnY小于HmX
难度: 中等查看答案及解析
-
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,加少量烧碱溶液可使溶液中
值增大。
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
H++OH-逆向移动,c(H+)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
难度: 中等查看答案及解析
-
向三份同浓度的25mL盐酸中分别加入质量不等的NaHCO3、KHCO3的混合物,测得产生气体的体积如下表所示(不考虑气体溶解)
编号
1
2
3
m(混合物)/g
4.6
7.2
7.9
V(CO2)(标准状况)/L
1.12
1.68
1.68
下列分析推理正确的是
A.根据实验1中的数据可以计算出盐酸的浓度
B.混合物中NaHCO3的质量分数约为45.7%
C.根据第2、3组数据可以分析出第2组中的混合物完全反应
D.盐酸的物质的量浓度为1.5mol.L-1
难度: 极难查看答案及解析
-
45mL某气体,可能含有CO2、O2、NH3将其通过浓硫酸,气体体积无变化,通过足量的Na2O2后,体积变为30mL,则该气体的组成为
A.CO2为30mL,为15mL B.NH3为30mL,O2为15mL
C.CO2为15mL,O2为30mL D.CO2 为30mL,O2为15mL
难度: 困难查看答案及解析