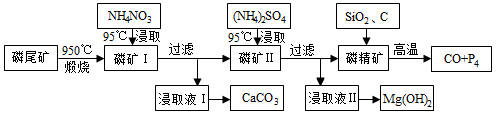
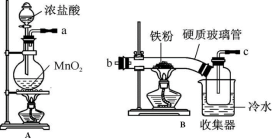
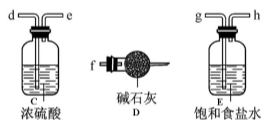
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
难度: 简单查看答案及解析
-
化学与生产生活密切相关,下列有关说法正确的是( )
A.点燃爆竹以后,硫燃烧生成SO3
B.福尔马林可以作食品保鲜剂
C.碳酸钠水溶液具有碱性,可用于制胃酸中和剂
D.中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是( )
A.NH4Br的电子式:
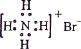
B.CO2分子比例模型:
C.乙酸的分子式: CH3COOH
D.NaH中氢离子结构示意图为
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氢氟酸、浓硝酸、硅酸钠溶液依次保存在棕色玻璃瓶、无色细口瓶、带胶塞细口瓶中
B.钠着火时不能用泡沫灭火器灭火
C.用饱和碳酸钠溶液除去CO2中混有的HCl
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A 标况下,11.2L 氟化氢中含有的分子数目为0.5NA
B.室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C.室温下,2L0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA
D.22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA
难度: 中等查看答案及解析
-
下列有关溶液中离子存在和转化的表达合理的是( )
A.Fe(OH)3溶于氢碘酸:Fe(OH)3
+3H+=Fe3++3H2O
B.由水电离出的c(OH-)=1×10-12mol
/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
C.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
D.标准状况下,将1.12LCO2气体通入1L0.1mol/L的KAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
SO2分别通入BaCl2和Ba(NO3)2溶液中
均有白色沉淀产生
沉淀成分为BaSO3
B
试液中滴加双氧水和硫氰化钾溶液
溶液变红
试液中一定含有Fe2+
C
把混有少量NaCl的蛋白质溶液放入半透膜袋中,进行渗析,取少量袋内液体,加硝酸酸化的AgNO3进行检验
产生白色沉淀
胶体和离子
都不能通过半透膜
D
向含有少量Fe2(SO4)3的CuSO4溶液中加入过量的CuO,过滤,取少量滤液,滴加KSCN溶液
不变红色
用这种方法可以得到纯净硫酸铜溶液
难度: 中等查看答案及解析
-
一定条件下,在某容器中发生了如图所示的反应,其中
和
代表不同元素的原子。关于此反应说法错误的是( )

A. 一定属于可逆反应 B.一定属于吸热反应
C.一定属于氧化还原反应 D.一定属于分解反应
难度: 简单查看答案及解析
-
已知O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.氧化剂与还原剂的物质的量之比为4:1
D.若生成4.48LHF,则转移0.8 mol电子
难度: 中等查看答案及解析
-
下列实验中,所选取的分离装置与对应原理都正确的是( )
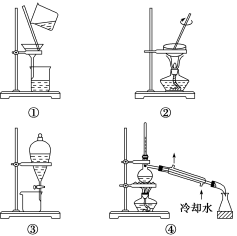
选项
目的
装置
原理
A
氢氧化铁胶体的纯化
①
胶体粒子不能通过滤纸,离子及小分子可以通过滤纸
B
分离苯中的溴苯
③
苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同
C
粗盐提纯
②
NaCl在水中的溶解度很大
D
除去环己醇中的环己烯
④
环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大
难度: 困难查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 中等查看答案及解析
-
有关能量的判断或表示方法正确的是 ( )
A.2H2(g)+O2(g) =2H2O(g)ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.从C(石墨,s)= C(金刚石,s) ΔH=+1.9 kJ/mol,可知:金刚石比石墨更稳定
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
D.化学反应中的能量变化,通常表现为热量的变化
难度: 中等查看答案及解析
-
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
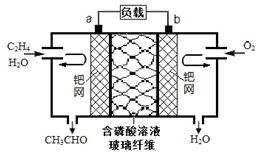
A.该电池可将化学能转化为电能
B.每有0.1mol O2反应,则迁移0.4mol H+
C.正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O
D.负极区溶液的pH减小
难度: 困难查看答案及解析
-
已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )
A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用
到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
难度: 极难查看答案及解析
-
向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是( )
A.Fe2O3与FeO的物质的量之比为1∶6
B.硝酸的物质的量浓度为3.0 mol/L
C.产生的NO在标准状况下的体积为4.48 L
D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol
难度: 困难查看答案及解析