-
下列常用化学品标志所涉及的物质中,一定能发生氧化还原反应的是
A
B
C
D




难度: 简单查看答案及解析
-
下列说法不正确的是
A.钠、钾着火时,不能用泡沫灭火器灭火
B.氧化铝是冶炼金属铝的原料,也是较好的耐火材料
C.石英是制造光导纤维的原料,也是常用的半导体材料
D.在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量
难度: 简单查看答案及解析
-
下列描述不涉及化学变化的是
A.铁粉作袋装食品的抗氧化剂 B.二氧化硫作纸浆的漂白剂
C.氢氟酸作普通玻璃的刻蚀剂 D.有机溶剂作食用油的萃取剂
难度: 中等查看答案及解析
-
下列水处理剂的工作原理与胶体有关的是
A.活性炭 B.氯气 C.明矾 D.次氯酸钠
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH = 1的溶液中:SO
、Cl−、NO
、Na+
B.在能使酚酞变红的溶液中:Na+、Cl−、NO
、K+
C.在1 mol·L-1的NaAlO2溶液中:K+、Ba2+、SO
、OH−
D.在1 mol·L-1的AlCl3溶液中:NH
、Ag+、Na+、NO
难度: 中等查看答案及解析
-
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色。下列说法不正确的是
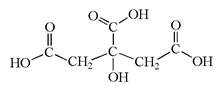
A.柠檬酸的分子式是C6H8O7
B.柠檬酸是易溶于水的有机物
C.柠檬酸分子中含有羧基和羟基
D.柠檬酸只能发生取代反应
难度: 中等查看答案及解析
-
下列解释事实的方程式正确的是
A.用氯化钠溶液做导电实验,灯泡发光:NaCl
Na++Cl-
B.氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+==Fe3++3H2O
C.石灰水表面漂着的“白膜”可用醋酸溶【解析】
CaCO3+2H+==Ca2++H2O+CO2↑D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
难度: 中等查看答案及解析
-
已知:2H2O2(l)==2H2O(l)+O2(g)∆H=−98kJ·mol−1。在含少量I-的溶液中,H2O2分解反应过程为:i.H2O2(l)+I-(aq)==H2O(l)+IO-(aq)∆H1
ii.H2O2(l)+IO-(aq)==H2O(l)+O2(g)+I-(aq)∆H2
下列说法不正确的是
A.∆H1 + ∆H2 = ∆H
B.I-是H2O2分解反应的催化剂
C.欲分解2 mol H2O2(l),至少需要提供98 kJ的热量
D.若生成1 mol O2,则反应ii转移电子的物质的量为2 mol
难度: 中等查看答案及解析
-
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。

下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
难度: 中等查看答案及解析
-
某同学进行下列实验:
装置
操作
现象

将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住
烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
难度: 中等查看答案及解析
-
下列实验方案中不能达到相应实验目的的是
A
B
C
D
方案
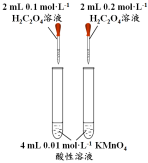

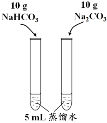
已知溶解度(20℃)
NaHCO3:9.6 g
Na2CO3:21.8 g
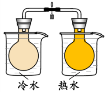
将NO2球浸泡在冷水和热水中
目的
探究浓度对化学
反应速率的影响
制备氨气
室温下比较NaHCO3和Na2CO3的溶解度
探究温度对化学平衡的影响
难度: 中等查看答案及解析
-
合成氨及其相关工业中,部分物质间的转化关系如下:
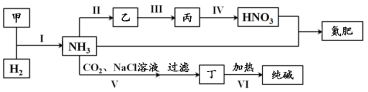
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
难度: 困难查看答案及解析
-
在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g)
N2O4(g) ∆H < 0。监测反应获得如下数据:
时间/s
0
20
40
60
80
n(NO2)/mol
0.40
n1
0.26
n3
n4
n(N2O4)/mol
0.00
0.05
n2
0.08
0.08
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol
难度: 困难查看答案及解析
-
已知:
。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(
)和c(H+),获得如右图所示的曲线。下列说法不正确的是
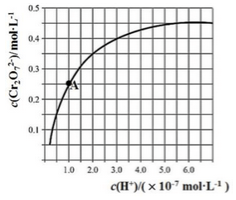
A.平衡时,pH越小,c(
)越大
B.A点CrO
的平衡转化率为50%
C.A点CrO
转化为
反应的平衡常数K=1014
D.平衡时,若溶液中c(
)=c(
),则c(H+) > 2.0×10-7 mol·L-1
难度: 困难查看答案及解析