-
冶炼金属一般有下列四种方法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。古代有:(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们冶炼方法进行对照分析,不正确的是 ( )
A. Ⅰ,① B. Ⅱ,② C.Ⅲ,③ D.Ⅳ,④
难度: 简单查看答案及解析
-
用铝热法还原下列物质,制得金属各1摩尔,消耗铝最少的是 ( )
A.MnO2 B.FeO C.Cr2O3 D.V2O5.
难度: 简单查看答案及解析
-
不需要化学变化就可能从海水中获得的物质是 ( )
A. 氯、溴、碘 B. 氯化钠 C. 烧碱、氢气 D. 钠、镁、铝
难度: 简单查看答案及解析
-
下列物质中属于高分子化合物的是 ( )
①硫化橡胶 ②蔗糖 ③油脂 ④酚醛树酯 ⑤蛋白质 ⑥焦炉煤气
A.①②③④⑤⑥ B.①③④⑤ C.①②④⑤⑥ D.①④⑤
难度: 简单查看答案及解析
-
有关煤的叙述中不正确的是( )
A.煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源物质
B.煤是多种有机物组成的混合物,内含煤焦油等成份
C.煤除了含有碳元素外,还含有少量的N、H、O、S
D.工业上, 煤的焦化可以获得洁净的燃料和多种化工原料。
难度: 简单查看答案及解析
-
将甲烷、氧气、过氧化钠置于密闭容器中,在150 0C时用电火花点燃,充分反应后容器内压强为零,则甲烷、氧气、过氧化钠的物质的量之比为
A. 1:2:3 B.2:1:6 C. 2:1:3 D 1:2:6
难度: 简单查看答案及解析
-
检查汽油中含有不饱和链烃的方法是 ( )
A.加入溴水振荡后,观察溴水层是否褪色
B.加入溴水振荡后,观察汽油层是否变为红棕色
C.加入酸性高锰酸钾溶液振荡后,观察是否褪色
D.通入氢气,观察是否发生
难度: 简单查看答案及解析
-
向100mL 18mol/L的硫酸溶液中加入足量的铜片并加热,充分反应后,被还原的硫酸物质的量 ( )
A.小于0.9 mol B.等于0.9 mol C.在0.9 mol到1.8 mol之间 D.大于1.8 mol
难度: 简单查看答案及解析
-
下列实验过程中始终无明显现象的是
A.二氧化氮通入硫酸亚铁溶液中 B.二氧化碳通入氯化钙溶液中
C. 二氧化碳通入饱和的碳酸钠溶液中 D.氨气通入氯化铝溶液中
难度: 简单查看答案及解析
-
下列说法正确的是
A.联合制碱法的优点是减少了对设备的腐蚀
B.工业生产硫酸时,用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率
C.合成氨是天然固氮的方法之一
D.碳酸钠俗称小苏打,甲烷是一种清洁能源
难度: 简单查看答案及解析
-
U是重要的核工业原料,在自然界的丰度很低。
U的浓缩一直为国际社会关注。下列有关
U说法正确的是 ( )
A.
U原子核中含有92个中子 B.
U原子核外有143个电子
C.
U与
U互为同位素 D.
U与
U互为同素异形体
难度: 简单查看答案及解析
-
1 g氢气燃烧生成液态水时放出142.9 kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g)
2H2O(l) ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)
2H2O(l) ΔH=-571.6 kJ·mol-1
C.2H2+O2
2H2O ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)
2H2O(l) ΔH=+571.6 kJ·mol-1
难度: 简单查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
难度: 简单查看答案及解析
-
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)
2NH3(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图:
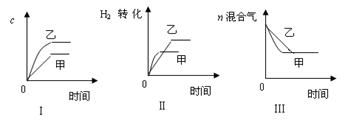
下列叙述正确的是
A.图Ⅰ研究的是温度对反应的影响,且甲的温度比乙高
B.图Ⅱ研究的是温度对反应的影响,且甲的温度比乙高
C.图Ⅱ研究的是压强对反应的影响,且甲的压强比乙大
D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高
难度: 简单查看答案及解析
-
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
难度: 简单查看答案及解析
-
右图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )。
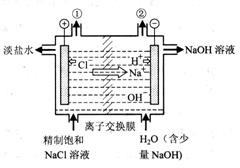
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为:
D.该装置是将电能转化为化学能
难度: 简单查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,电解总反应:2Cu+H2O=Cu2O+H2
。下列说法正确的是 ( )
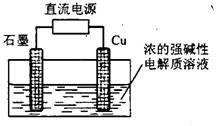
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
难度: 简单查看答案及解析
-
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A.立刻褪色 B.慢慢褪色
C.先褪色,后复原 D.颜色不褪
难度: 简单查看答案及解析
-
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
Ca(OH)2(s)
Ca(OH)2(aq)
Ca2+(aq)+2OH-(aq),
当向此悬浊液中加入少量生石灰时,下列说法正确的是
A.n(Ca2+)增大 B.c(Ca2+)不变 C.n(OH-)增大 D.c(OH-)减小
难度: 简单查看答案及解析




