-
下列实验事实可用同一原理解释的是( )
A. 乙烯和双氧水都能使酸性高锰酸钾溶液褪色
B. 氯水和二氧化硫都能使紫色石蕊试液变色
C. 将苯和裂化汽油分别滴入溴水中.水层褪色
D. 加热盛有I2和NH4Cl的试管,管口有固体凝结
难度: 中等查看答案及解析
-
化学与生活密切相关。下列有关说法不正确的是( )
A. 把肥皂水涂抹在液化石油气罐阀门处可检验其是否漏气
B. 天然气中加入少量特别气味的气体,用以警示气体的泄漏
C. 用氯气杀灭游泳池水中绿藻时,同时加入H2O2 可提高杀灭效果
D. 除去银器表面黑色的Ag2S,可将其放入盛有食盐水的铝容器中煮沸
难度: 中等查看答案及解析
-
根据实验操作及现象所得出的结论正确的是( )
选项
操作及现象
结论
A
常温下,测定等浓度的Na2CO3、Na2SO3溶液的pH,前者的pH比后者大
非金属性:C<S
B
盛有稀HNO3的试管中加入足量铁粉,充分反应后滴入几滴KSCN溶液,无明显现象
Fe 不能被HNO3氧化成Fe3+
C
SO2通入Ba(NO3)2溶液中,产生白色沉淀
SO2被氧化,沉淀为BaSO4
D
向NaOH溶液中滴加浓度均为0.1mol·L-1的FeCl3和AlCl3混合溶液,出现红褐色沉淀
Ksp[FeOH)3]<Ksp[Al(OH)3]
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
阿伏加德罗常数的值为N A。下列有关叙述正确的是( )
A. 60 gSiO2中含Si-O键数目为2 NA
B. 标准状况下,11.2 L乙酸含氢原子数为2 NA
C. 1L1mol·L-1 Na2S溶液中硫离子数为NA
D. 44 g由CO2和C3H8组成的混合气体中分子总数为NA
难度: 中等查看答案及解析
-
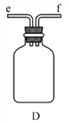
四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c 为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
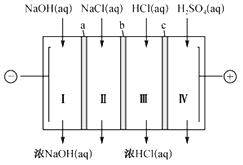
A. b、c 分别依次为阳离子交换膜、阴离子交换膜
B. 通电后Ⅲ室中的Cl-透过c 迁移至阳极区
C. Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D. 电池总反应为4NaCl+6H2O
4NaOH+4HCl+2H2↑+O2↑
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期非金属主族元素,q、r、s、h 是这些元素形成的物质,其中h 是离子化合物,q是制太阳能电池的主要原料,s常温下呈气态且其水溶液显碱性,r为二元化合物,其浓溶液在空气中易形成白雾。下列说法正确的是( )
A. Y 与X属于同一主族,与Z属于同一周期 B. 单质的沸点:X>Z
C. 常温常压下,W的氧化物为液态 D. X的氧化物均能用向上排空气法收集
难度: 困难查看答案及解析
-
R(OH)2和W(OH)2均难溶于水,且R2+和W2+均能水解,常温下,R(OH)2和W(OH)2饱和溶液中,金属阳离子的p(M2+)[p(M2+)=-lgc(M2+)]随溶液pH的变化关系如右图所示。已知:Ksp[R(OH)2]sp[W(OH)2]。则下列说法中错误的是( )
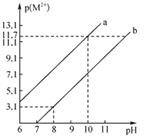
A. a线表示饱和溶液中p(R2+ )随溶液pH变化关系
B. R(OH)2和W(OH)2沉淀共存的溶液中存在
=104.6
C. 常温下,R(OH)2在饱和W(OH)2溶液中的溶解度比在纯水中的小
D. 若RSO4溶液中含有少量W2+,可加入适量RCO3除去W2+
难度: 困难查看答案及解析
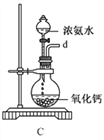
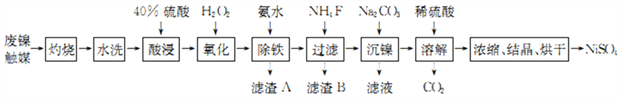
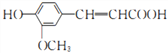 )能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):
)能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):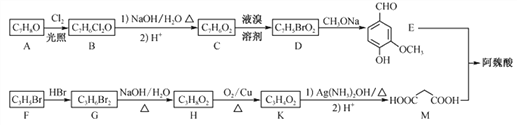
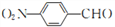 ,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。
,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。