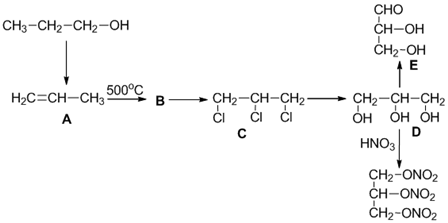
-
化学在生产和生活中有着重要的作用,下列有关说法正确的是( )
A. 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
B. 利用二氧化碳制造可降解塑料,可以减缓“白色污染”,减轻温室效应
C. 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
D. 通过化学变化可以实现12C与14C间的相互转化
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数的值,下列说法正确的是( )
A. 60g丙醇中含有的共价键的数目为10NA
B. 在含有1mol FeI2 的溶液中,通过足量的氯气,转移的电子数是3NA
C. 某溶液中Na2CO3和NaHCO3的浓度均为0.1mol/L ,Na+离子总数为0.3NA
D. 50mL 12mol/L 盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。桂皮中含有肉桂醛,结构如右图,杏仁中含有苯甲醛。以下说法错误的是( )
A. 肉桂醛分子中含有两种官能团,分子式为C9H8O
B. 肉桂醛分子中最多有18个原子共平面
C. 1 mol肉桂醛与氢气加成时最多消耗4 mol H2
D. 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应
难度: 中等查看答案及解析
-
以下实验操作及现象合理的是( )
A. 为检验SO42-需要滴加稀硝酸酸化的BaCl2溶液并观察是否有白色沉淀生成
B. 把光洁无锈的铁丝放在煤气灯外焰灼烧至与原来的火焰颜色相同时,蘸取K2CO3溶液并灼烧,透过蓝色钴玻璃可观察到火焰为淡紫色
C. 向盛有足量苯酚溶液的试管中滴加少量稀溴水,可观察到白色沉淀生成
D. 实验室制备乙炔时,常用NaOH溶液除去产生的H2S、PH3等杂质
难度: 中等查看答案及解析
-
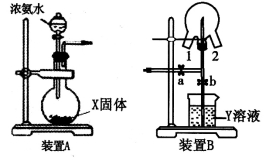
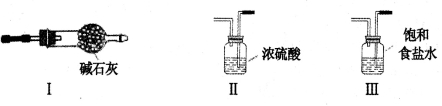
下列选用的仪器和药品能达到实验目的的是( )
A
B
C
D
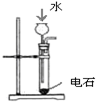

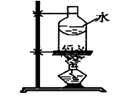

制乙炔的发生装置
蒸馏时的接收装置
分离固体氯化钠和碘单质
准确量取一定体积K2Cr2O7标准溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
难度: 简单查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示, 其中T单质和H2在光照的条件下发生爆炸。则下列判断正确的是

A.五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强
B.氢化物的稳定性:R>Q>X;R>T>X
C.Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质
D.X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强
难度: 极难查看答案及解析