-
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料
难度: 简单查看答案及解析
-
下列有关物质分类或归纳不正确的是
①电解质:明矾、冰醋酸、氯化银、纯碱 ②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银 ④同素异形体:金刚石、石墨、C60、C70
A.①② B.②③ C.③④ D.②④
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值.下列说法不正确的是
A.常温常压下,18g14CH4所含中子数目为8NA
B.常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.含0.3molCl-的FeCl3水解制成胶体,所得胶体粒子数为0.1NA
D.60gSiO2晶体中含有硅氧键的数目为4NA
难度: 中等查看答案及解析
-
M、X、Y、Z、W为五种短周期元素,原子序数依次递增,X、Y、Z是同周期元素,且最外层电子数之和为15,X与Z可形成气体分子XZ2,Y与M形成的气态化合物密度在相同状况下是氢气的8.5倍,W的质子数是M、X、Y、Z四种元素质子数之和的一半。下列说法正确的是
A.原子半径:M>Z>Y>X>W
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X、Y、Z、M四种元素形成的化合物不能含有离子键
D.由X元素形成的某种单质能导电,可以做电极
难度: 中等查看答案及解析
-
能正确表示下列离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O
B.铜与浓硫酸混合加热:Cu+2H2SO4(浓)
Cu2++SO42—+2H2O+SO2↑
C.过量的浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
D.明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO SO42—+2Ba2++3OH- = 2BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
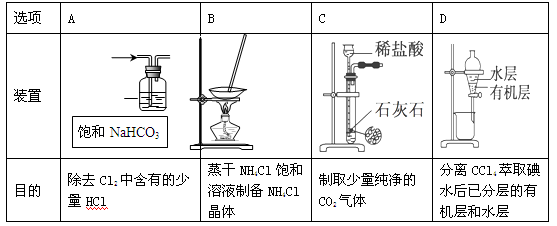
难度: 中等查看答案及解析
-
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0.00g白色沉淀,则a的数值为
A.4.92 B.6.42 C.7.18 D.14.82
难度: 中等查看答案及解析