-
(18分)A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式 ;
(2)A的常见氢化物AH3 的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为 。
(4)E的最高价氧化物的结构式为 中心原子的杂化方式为 。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示 原子。
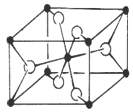
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以 (填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
-
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为________R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为________
(2)CB3分子的空间构型是________,其中心原子的杂化类型是________
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含________个δ键。
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为________ 正极反应为 ________
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为________ (已知:E的燃烧热为Y KJ/mol)
-
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子.请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为________R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为________
(2)CB3分子的空间构型是________,其中心原子的杂化类型是________
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含________个δ键.
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为________ 正极反应为________
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为________ (已知:E的燃烧热为Y KJ/mol)
-
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子, 比
比 少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
 分子中心原子的杂化类型是 ______ 。
分子中心原子的杂化类型是 ______ 。
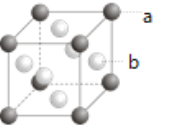
 元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。
元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。
 、D元素最高价氧化物对应的水化物的酸性强弱: ______
、D元素最高价氧化物对应的水化物的酸性强弱: ______  ______
______  填化学式
填化学式 。
。
 用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
 分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
-
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是________。
(2)F元素的原子的外围电子排布式为________;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。

(3)B、D元素最高价氧化物对应的水化物的酸性强弱:________>________(填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
-
【化学—选修3 物质结构与性质】(15分)
A、B、C、D、E是原子序数逐渐增大的1-36号元素。A原子核外有4个原子轨道填充了电子;B的第一电离能比同周期相邻元素的第一电离能大,其气态氢化物在水中的溶解度在同族元素氢化物中最大;C的最高化合价和最低化合价的代数和为4;D原子的M层和N层电子数均比E原子少4个,E是人体必须的微量元素。
试根据以上信息,回答下列问题:
(1)A原子的电子排布图________,E原子的外围电子排布式为________。
(2)AC2分子中含有________个π键。
(3)含C50%的C的氧化物的空间构型为_________,C的原子轨道采用______杂化。
(4)写出A的常见氧化物与B的氧化物中互为等电子体的一组 。
(5)已知D的晶体在不同温度下有A、B两种堆积方式, 则A、B两晶胞中D原子的配位数之比________; 晶体的密度之比为________。
-
现有前四周期的5种元素的部分信息如下表所示:
| 元素代号 | 元素部分信息 |
| X | X的阴离子核外电于云均呈球形 |
| Y | 原子的能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
| Z | 基态原于核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
| R | 元素原于的围电子排布式为nsn-1npn-1 |
| T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题:
(1)基态T2+的电子排布式为____________。
(2)Y.Z.R 的电负性由大到小的顺序为____________ (用元素符号表示)。
(3)YX4+的空间构型为____________,离子中Y原子的杂化轨道类型为____________ ,YX4+电子式为________。
(4)YX3的一种等电子体分子是______,YX3 的键角大于X2Z的键角的主要原因是________。
(5)T单质不溶于YX3溶液,也不溶于X2Z溶液,但能溶于它们的混合溶液,其主要原因是形成了稳定的[T(YX3)4]2+,1mol该阳离子中共含有______mol σ键。
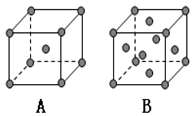
(6)Z、T组成的晶胞结构如下图所示。已知Z、T原子的半径分别为apm、bpm,晶胞边长为cpm,则该晶胞中原子的空间利用率为________(用代数式表示)。

-
有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为________。ACl3分子的空间构型为________。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,
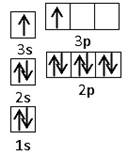
该同学所画的电子排布图违背了________。
(3)A、B、C三元素原子第一电离能由大到小的顺序为________(用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为________。
(4)D的基态原子有________种能量不同的电子;D2+ 的价电子排布式为________。已知D晶体中微粒的堆积方式为面心立方堆积,晶体中一个晶胞的边长为a cm,则D晶体的密度为 ________(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
-
【化学——选修3:物质结构与性质】
有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn-1npn-1。 D原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为 。ACl3分子的空间构型为 。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。

(3)A、B、C三元素原子第一电离能由大到小的顺序为 (用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为 。
(4)D的基态原子有 种能量不同的电子;D2+ 的价电子排布式为 ;下图 (填甲、乙或丙)表示的是D晶体中微粒的堆积方式。若该晶体中一个晶胞的边长为a cm,则D晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则D晶胞这种堆积模型的空间利用率为 。(用含r的式子表示,不需化简)
甲 乙 丙
-
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子, 比
比 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为
少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 ,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中
,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中 与
与 离子数之比为2:1。请回答下列问题:
离子数之比为2:1。请回答下列问题:
(1) 形成的晶体属于______
形成的晶体属于______  填写离子、分子、原子
填写离子、分子、原子 晶体.
晶体.
(2) 的电子排布式为______,在
的电子排布式为______,在 分子中C元素原子的原子轨道发生的是______杂化,
分子中C元素原子的原子轨道发生的是______杂化, 分子的VSEPR模型为______.
分子的VSEPR模型为______.
(3) 的氢化物在水中的溶解度特别大,原因______
的氢化物在水中的溶解度特别大,原因______
(4) 元素与同周期相邻元素的第一电离能由大到小的关系是:______
元素与同周期相邻元素的第一电离能由大到小的关系是:______ 用元素符号表示
用元素符号表示 ;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
(5)已知下列数据:


由 和
和 反应生成CuO的热化学方程式是______.
反应生成CuO的热化学方程式是______.






