-
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为______,其中含有的化学键类型为______.
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为______
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为______mol.
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)______.
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是______.
(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是______.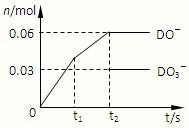
难度: 中等查看答案及解析
-
运用化学反应原理研究以下问题:
(1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”),平衡常数K______(填“变大”、“变小”或“不变”);使用催化剂______反应的△H(填“增大”、“减小”或“不改变”).
(2)在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25°CKsp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(3)在25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显______性(填“酸”、“碱”或“中”);且a______0.01(填“>”、“=”或“<”).
(4)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是______;电解质溶液Y是______;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为______.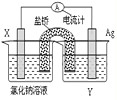
难度: 中等查看答案及解析
-
某学习小组对教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究.
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味.压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态.
同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性.其中依据不充分的是______(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置: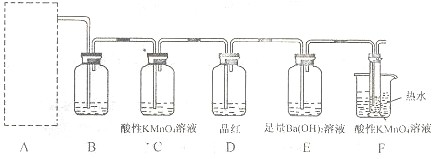
试回答下列问题:
①上图A中应选用下列装置______(填编号).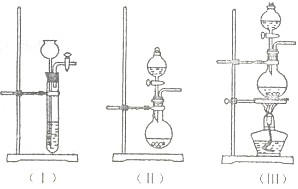
②B装置所装试剂是______;D装置中试剂的作用是______;E装置中发生的现象是______;
③A装置中使蔗糖变黑的化学反应方程式为______难度: 中等查看答案及解析
-
[化学-物质结构与性质]
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,______元素的原子的第一电离能最大,理由是:______.
(2)C元素原子的第一电离能______(填“>”“<”“=”)D,理由是:______.
(3)上述六种元素按电负性从小到大的排列是______.
(4)C、D、E、F元素形成的最高价氧化物分别是______(填“离子”“共价”)化合物.
(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:______.难度: 中等查看答案及解析
-
[化学-有机化学基础]
一氯乙酸(ClCH2COOH)是无色晶体,可溶于水,其水溶液显酸性,是重要的有机反应中间体,可进行多种反应.
(1)一定条件下,一氯乙酸与苯可直接合成苯乙酸,其反应方程式是______(不要求标出反应条件).
(2)工业上将一氯乙酸、2-丙醇与浓硫酸混合加热制备一氯乙酸异丙酯,一氯乙酸异丙酯的结构简式为______;反应过程中,可能产生的有机副产物有异丙醚[(CH3)2CHOCH(CH3)2]和______(填结构简式).
(3)pKa常用于表示物质的酸性强弱,pKa的数值越小,该物质的酸性越强.已知卤素原子对饱和脂肪酸的酸性影响具有相似性.25℃时一些卤代饱和脂肪酸的pKa数值如下:
可见,25℃时卤素原子对卤代饱和脂肪酸的酸性影响有(写出2条即可):卤代酸 F3CCOOH Cl3CCOOH F2CHCOOH FCH2COOH CH3CH2CHClCOOH pKa 0.23 0.65 1.24 2.66 2.85 卤代酸 ClCH2COOH BrCH2COOH ICH2COOH CH3CHClCH2COOH Cl③CH2CH2CH2COOH pKa 2.86 2.90 3.18 4.06 4.52
①______;
②______;
③______;
根据上述数据和规律判断,Cl2CHCOOH的pKa的数值范围为______.难度: 中等查看答案及解析