-
运用化学反应原理研究以下问题:
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”),平衡常数K______(填“变大”、“变小”或“不变”);使用催化剂______反应的△H(填“增大”、“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”),平衡常数K______(填“变大”、“变小”或“不变”);使用催化剂______反应的△H(填“增大”、“减小”或“不改变”).
(2)在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25°CKsp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(3)在25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显______性(填“酸”、“碱”或“中”);且a______0.01(填“>”、“=”或“<”).
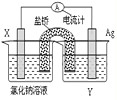
(4)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是______;电解质溶液Y是______;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为______.
-
(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)________。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)________。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
 2 N2O5(g) 4NO2(g)+O2(g) △H>0
2 N2O5(g) 4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为________。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2T1(填
“>”“<”“=” )
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式________
________
②用电离方程式表示肼的水溶液呈碱性的原因________
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼________。说明原因________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)⇌2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡______移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H______(填“增大”“减小”或“不改变”).
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(3)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式______.
(5)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=______.
(6)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显______性(填“酸”“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=______.
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e-1  PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)⇌2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡______一移动(填“向左”“向右”或“不”,下同),反应的△H______(填“增大…‘减小”或“不变”).使用催化剂则平衡______移动,反应的△H______(填“增大”、“减小”或“不变”).
(2)已知:O2(g)═O2+(g)+eˉ△H1=+1175.7kJ/mol
PtF6(g)+e-⇌PtF6ˉ (g)△H2=-771.1kJ/mol
O2+PtF6ˉ(s)═O2+(g)+PtF6ˉ(g)△H3=+482.2kJ/mol
则反应O2(g)+PtF6(g)═O2+PtF6ˉ(S) 的△H=______.
(3)在25℃下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,生成______沉淀(填化学式),生成该沉淀的离子方程式为______.
已知25℃时Ksp[Mg(OH)2]=1.8×10ˉ11,Ksp[Cu(OH)2]=2.2×10ˉ20.
(4)7℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol/L、c(N2O4)=0.0120mol/L.计算反应2NO2(g)⇌N2O4(g)的平衡常数K值为______.(保留至0.1)
-
(16分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”),在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”) 。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”),在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”) 。
(2) O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e-1  PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
-
运用化学反应原理研究氮、氧、镁、铜等元素及其化合物的性质。
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动________(填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH________(填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动________(填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH________(填“增大”“减小”或“不改变”)。
 ⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是________
⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是________
①Cl->H+>NH4+>OH-;②Cl->NH4+>H+>OH-;③Cl-=NH4+>H+=OH-;④NH4+>Cl->OH->H+
⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
成_______沉淀(填化学式),生成该沉淀的离子方程式为_________________________;继
续滴加氨水,最后一步发生的反应的离子反应方程式________
参考数据:25℃,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
⑷有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电
解质溶液环境制备新型燃料电池。则该燃料电池负极附近的pH____(填“增大”、“减小”或“不变”);正极的电极反应方程式为_____________________
-
(18分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式________。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va︰Vb=________。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
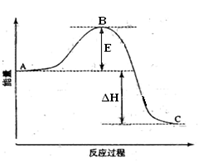
(1)图中A表示,E的大小对该反应的反应热有无影响?。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH________(填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)=mol·L—1·min—1
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH________(填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)=mol·L—1·min—1
 (3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 ________。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 ________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。
-
(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。

