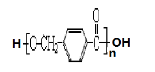-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.新型材料聚酯纤维、光导纤维都属于有机高分子
难度: 简单查看答案及解析
-
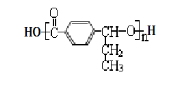
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.将过量SO2气体通入氨水中:SO2+2 NH3·H2O =2 NH4+ + SO32-+H2O
B.向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3- = BaCO3↓+2H2O+ CO32-
D.硝酸铁溶液中滴加足量HI溶液:Fe3+ + 3NO3-+12H+ +10I- = Fe2+ + 5I2 + 3NO↑ + 6H2O
难度: 困难查看答案及解析
-
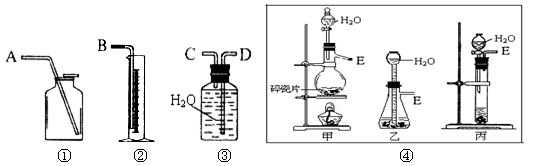
下列图中的实验方案,能达到实验目的的是
A
B
C
D
实验
方案
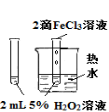
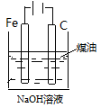
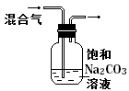
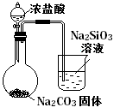
实验
目的
验证FeCl3对H2O2分解反应有催化作用
制备Fe(OH)2并能较长时间观察其颜色
除去CO2气体中混有的SO2
比较HCl、H2CO3和H2SiO3的酸性强弱
难度: 中等查看答案及解析
-
下图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是:
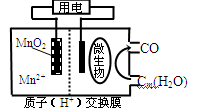
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O
难度: 中等查看答案及解析
-
常温时,将某浓度的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液的说法正确的是
A.混合后溶液pH=7
B.所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1
D.混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-)
难度: 中等查看答案及解析
-
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.
H2SO4(aq)+
Ba(OH)2(aq)===
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
难度: 中等查看答案及解析