-
化学与生活、社会密切相关,下列说法正确的是
A.SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气
B.由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.金属钠通常被保存在煤油中,以隔绝空气
难度: 中等查看答案及解析
-
符合图中阴影部分的物质是
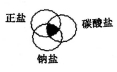
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是
A.1L 0.5mol·L-1氨水中所含NH4+数为0.5NA
B.1mol Fe与足量氯气反应转移的电子数为2NA
C.标准状况下,33.6L CO2约含有1.5NA个分子
D.1 mol
中含碳碳双键数为3NA
难度: 困难查看答案及解析
-
下列说法正确的是
A.16O和18O原子的核外电子排布不相同
B.含有离子键的化合物一定是离子化合物
C.HF、HCl、HBr、HI的熔沸点逐渐升高
D.干冰和二氧化硅熔化时所克服微粒间的相互作用相同
难度: 中等查看答案及解析
-
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中只存在上述一种作用方式的是
A.二氧化碳 B.氢氧化钠固体 C.NaCl晶体 D.氯气
难度: 中等查看答案及解析
-
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
A.①③④ B.①②⑤ C.③④ D.③④⑤
难度: 困难查看答案及解析
-
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是
A.S2Cl2既作氧化剂又作还原剂
B.H2O作还原剂
C.每生成1 mol SO2转移4 mol电子
D.氧化产物与还原产物物质的量之比为3∶1
难度: 困难查看答案及解析
-
下列离子或分子在溶液中能大量共存的是
A.K+、CH3COOH、Br-、SiO32- B.K+、Na+、Cl-、CO32-
C.Na+、Al3+、NH3·H2O、MnO4- D.H+、Fe2+、SO42-、NO3-
难度: 中等查看答案及解析
-
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是
A.Fe、Cu、Ag、Al、Mg B.Mg、Cu、Al、Ag、Fe
C.Al、Cu、Ag、Mg、Fe D.Mg、Ag、Cu、Al、Fe
难度: 中等查看答案及解析
-
核潜艇上的核反应堆内使用了液体铝合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.离子半径:Na+>Al3+
B.铝钠合金若投入一定水中可得无色溶液并产生气泡
C.若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
难度: 中等查看答案及解析
-
离子方程式正确的是
A.醋酸溶解鸡蛋壳:2H++ CO32-
CO2↑+ H2O
B.铝片加入烧碱溶液:2A1+ 2OH—+ 2H2O
2A1O2—+ 3H2↑
C.铁与盐酸反应:2Fe + 6H+
2Fe3+ + 3H2↑
D.铜片投入FeCl3溶液中:Cu+ Fe3+
Cu2+ + Fe2+
难度: 中等查看答案及解析
-
元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
A.R的氧化物在空气中与其它物质作用可形成光化学烟雾
B.常温下丁的浓溶液可用T单质所制的容器来盛装
C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D.甲、乙、丙、丁受热均易分解
难度: 中等查看答案及解析
-
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
①CH4(g)+4NO2 (g)===4NO(g)+CO2 (g)+2H2 O(g) ΔH1=-574 kJ·mol-1
②CH4 (g)+4NO(g)===2N2 (g)+CO2 (g)+2H2 O(g) ΔH2=-1160 kJ·mol-1
下列选项不正确的是
A.CH4 (g)+2NO2 (g)===N2 (g)+CO2 (g)+2H2 O(g) ΔH=-867 kJ·mol-1
B.CH4 (g)+4NO2 (g)===4NO(g)+CO2 (g)+2H2O(l) ΔH3<ΔH1
C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ
D.若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol
难度: 中等查看答案及解析
-
下列相关实验不能达到预期目的的是
相关实验
预期目的
A
向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3
验证火柴头含有氯元素
B
试样加水溶解后,再加入足量Ba(OH)2溶液,有白色沉淀生成
检验NaHCO3固体中是否含
Na2CO3
C
向溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体
证明原溶液中含有NH4+
D
两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液
探究FeCl3溶液对H2O2分解速率的影响
难度: 困难查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
难度: 困难查看答案及解析
-
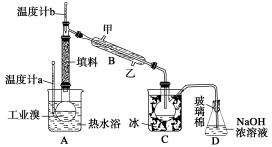
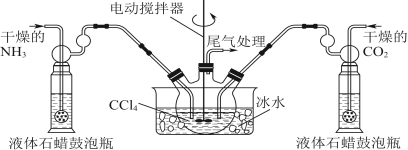
下列实验装置正确且能完成实验目的的是

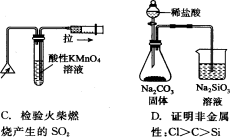
难度: 中等查看答案及解析
-
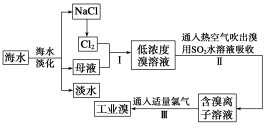
下列说法错误的是
A.电解饱和食盐水可制取烧碱、氯气、氢气
B.从海水中可提取镁、溴、碘等物质
C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D.在镀件上镀铜,镀件作阴极
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如下图所示。下列有关说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 困难查看答案及解析
-
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),5 min后反应达到平衡时C(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
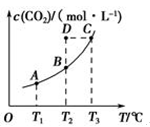
A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1
B.反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g)的ΔH<0
C.在T2℃时,若反应处于状态D,则一定有v正<v逆
D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2
难度: 困难查看答案及解析
-
镁铝合金5.1g溶于300mL 2mol/L盐酸中,标准状况下放出气体体积为5.6L,向反应后的溶液中加入500mLNaOH溶液充分反应,最终产生白色沉淀.下列有关说法不正确的是
A.5.1g镁铝合金中含有镁、铝的质量分别为2.4g、2.7g
B.溶解5.1g镁铝合金时,剩余盐酸的物质的量为0.1mol
C.生成白色沉淀的最大质量为13.6g
D.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2mol/L
难度: 困难查看答案及解析