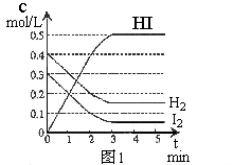
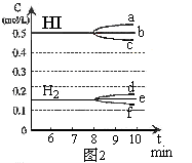
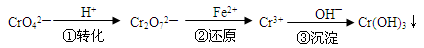-
2010年诺贝尔化学奖授予理查德·赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是
A.催化剂只改变反应的正反应速率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂不能改变反应物的转化率
难度: 中等查看答案及解析
-
下列说法正确的是
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素
难度: 中等查看答案及解析
-
在相同温度和压强下,将等质量的硫分别在足量的纯氧气和空气中燃烧,设前者放出的能量为Q1,后者放出的能量为Q2,则Q1和Q2的相对大小关系为
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断
难度: 中等查看答案及解析
-
在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) ΔH=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) ΔH=+1452 kJ/mol
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH = +11.9kJ·mol-1 ”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH =-57.3l kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+1/2O2(g)=H2O(l) ΔH = + 285.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的 ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)= CO2(g)+2H2O(l)ΔH=-Q1 kJ/mol;
2H2(g)+O2(g)= 2H2O(g)ΔH =-Q2 kJ/mol ;
2H2(g)+O2(g)= 2H2O(l)ΔH =-Q3 kJ/mol。取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为
A.4Q1+0.5Q3 B.4Q1+0.5Q2 C.4Q1+Q3 D.4Q1+2Q2
难度: 中等查看答案及解析
-
已知反应A(g)+3B(g)===2C(g)+D(g)在某段时间内以A的浓度变化表示的化学反应速率为1 mol/(L·min),则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5 mol/(L·min) B.1 mol/(L·min)
C.2 mol/(L·min) D.3 mol/(L·min)
难度: 中等查看答案及解析
-
反应2A(g)
2B(g)+E(g)ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减少E的浓度 D.降温
难度: 中等查看答案及解析
-
现有下列各组溶液:
①10℃时10 mL 0.1 mol/L的Na2S2O3溶液和50 mL0.05 mol/L的H2SO4溶液;
②10℃时10 mL 0.05 mol/L的Na2S2O3溶液和10 mL 0.1 mol/L的H2SO4溶液;
③30℃时10 mL 0.05 mol/L的Na2S2O3溶液和10 mL 0.1 mol/L的H2SO4溶液。
若同时将它们混合发生反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,则出现浑浊的先后顺序是
A.①②③ B.②①③ C.③②① D.①③②
难度: 中等查看答案及解析
-
一定条件下的密闭容器中:4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,
下列叙述正确的是
A.4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B.平衡时v正(O2)=
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
难度: 中等查看答案及解析
-
一定温度时,反应2HBr(g)
H2(g)+Br2(g) ΔH>0 达到平衡,要使混合气体颜色加深,可采用的方法是
A.减小压强 B.缩小体积 C.降低温度 D.增大H2的浓度
难度: 中等查看答案及解析
-
在密闭容器中进行反应2SO2 + O2
2SO3 ,SO2、O2、SO3的起始浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当平衡时,下列数据正确的是
A.SO2的浓度为0.25 mol·L-1 ,SO3的浓度为0.25mol·L-1
B.SO3的浓度为0.3mol·L-1
C.SO2的浓度为0.4 mol·L-1 ,O2的浓度为0.2 mol·L-1
D.SO3的浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g)
2C(g) ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,v(B)=0.075 mol/(L·s)
B.4 s后平衡状态下,c(A)∶c(C)=2∶1
C.达到平衡状态时,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
难度: 中等查看答案及解析
-
可逆反应 2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
A.增加A的量,B的转化率提高
B.压强增大平衡不移动,v(正)、v(逆)均不变
C.增大B的浓度,v(正)>v(逆)
D.升高温度,平衡向逆反应方向移动,v(正)减小
难度: 中等查看答案及解析
-
在恒容密闭容器中,一定温度下,可逆反应A(s)+3B(g)
2C(g) +D(g)达到平衡状态的标志是
A.混合气体的密度不再改变的状态
B.单位时间生成2n mol C,同时生成n mol D
C.混合气体的压强不再改变的状态
D.A、B、C、D的分子数之比为1∶3∶2∶1
难度: 中等查看答案及解析
-
在一定温度下,把3.0 moLM和2.5 moLN混合于2.0 L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g)
XP(g)+2W(g),5 min后反应达到平衡,容器内的压强变小,已知W的平均反应速率为0.10 mol·L-1·min-1,下列说法错误的是
A.X的值为1 B.M的平均反应速率为0.15 mol·L-1·min-1
C.M的转化率为60% D.平衡时P的浓度为0.25 mol·L-1
难度: 中等查看答案及解析
-
可逆反应 CO(g)+ H2O(g)
CO2(g) + H2(g),在密闭容器中反应。 已知温度为749K时,K = 1,当CO的起始浓度为2 mol·L-1,H2O的起始浓度为6mol·L-1,达到平衡时,CO的转化率为
A.80% B.75% C.50% D.25%
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)
Z(g)+W(s) ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.平衡后加入X,上述反应的ΔH增大
C.升高温度,平衡逆向移动
D.当容器中气体压强不变时,反应达到平衡
难度: 中等查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2),则下列说法正确的是
反应时间/min
n(CO)/mol
H2O/ mol
0
1.20
0.60
t1
0.80
t2
0.20
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率减小
D.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
难度: 中等查看答案及解析
-
下图表示外界条件(温度、压强)的变化对下列反应的影响:
L(s)+G(g)
2R(g)ΔH<0。在图中,Y轴是指

A.平衡混合气中G的质量分数 B.平衡混合气中R的质量分数
C.G的转化率 D.L的转化率
难度: 中等查看答案及解析
-
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)
cC(g)+dD(g) ΔH<0。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是

A.达到化学平衡时A的消耗速率与C的消耗速率相等
B.保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动
C.保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变
D.图像中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度
难度: 中等查看答案及解析
-
在某温度下,将2molA和3molB充入一密闭容器中,发生如下反应:
aA(g)+B(g)
C(g)+D(g),5min后达平衡,已知各物质的平衡浓度的关系为:
c a(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A 的转化率没有发生变化,则B的转化率为
A.60% B.40% C.24% D.4%
难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
在2 L密闭容器中,加入X和Y各4 mol,一定条件下发生化学反应:2X(g)+ 2Y(g)
Z(g)+2 W(g)ΔH <0,反应进行到5 s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5 mol/L,则下列说法正确的是
A.5 s内平均反应速率为υ(Y)= 0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
难度: 中等查看答案及解析