-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是( )
A.石灰石在高温下的分解反应 B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应 D.木炭在氧气中燃烧
难度: 简单查看答案及解析
-
下列关于原电池的叙述中,正确的是( )
A.把电能转化为化学能,使溶液发生氧化还原反应
B.电子从活泼金属流向不活泼金属,不活泼金属为负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
难度: 简单查看答案及解析
-
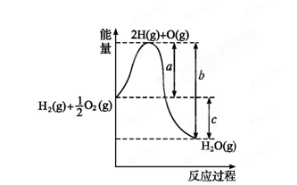
在101 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的
表示参加反应的O2的分子数目
C.燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ·mol-1
难度: 中等查看答案及解析
-
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
A.用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等)
B.放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等
C.手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收
D.目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放
难度: 简单查看答案及解析
-
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-2 878 kJ·mol-1 B.ΔH=-2 658 kJ·mol-1
C.ΔH=-1 746 kJ·mol-1 D.ΔH=-1 526 kJ·mol-1
难度: 简单查看答案及解析
-
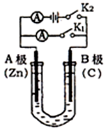
铜锌原电池(如图)工作时,下列叙述正确的是 ( )
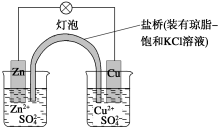
A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
电化学装置工作时,下列电极上发生的反应一定是氧化反应的是( )
A.阴极 B.负极 C.铜电极 D.石墨电极
难度: 简单查看答案及解析
-
已知:H(g) + H(g) = H2(g) ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
A..氢原子的能量比氢分子的能量低
B.两个氢原子结合成一个氢分子时放出435.7kJ能量
C.1mol氢分子分解成2mol氢原子要吸收435.7kJ能量
D.2mol氢原子结合1mol氢分子成要吸收435.7kJ能量
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是( )
A.KNO3 B.Na2S C.Ba(OH)2 D.H2SO4
难度: 简单查看答案及解析
-
已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ·mol-1
C(s)+O2 (g)=CO2(g), △H2= -393.5kJ/mol 则 C(s)+CO2(g)=2CO(g) 的△H为
A.283. kJ·mol-1 B.+172.5 kJ·mol-1
C.-172.5 kJ·mol-1 D.-504 kJ·mol-1
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3 C.ΔH1=ΔH2<ΔH3 D.ΔH1<ΔH2=ΔH3
难度: 简单查看答案及解析
-
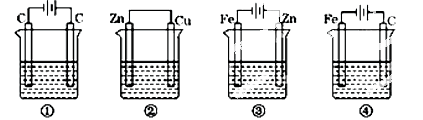
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )
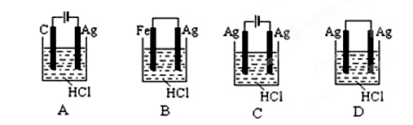
难度: 简单查看答案及解析
-
同温同压下,已知下列各反应均为放热反应,其中放热最少的是( )
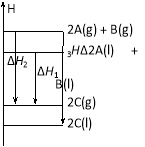
A.2A ( l ) + B ( l ) = 2C ( g ) ΔH1 B.2A ( g ) + B ( g ) = 2C ( g ) ΔH2
C.2A ( g ) + B ( g ) = 2C ( l ) ΔH3 D.2A ( l ) + B ( l ) = 2C ( l ) ΔH4
难度: 简单查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2 下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
难度: 困难查看答案及解析
-
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
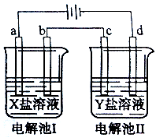
选项
X
Y
A.
MgSO4
CuSO4
B.
AgNO3
Pb(NO3)2
C.
FeSO4
Al2 (SO4)3
D.
CuSO4
AgNO3
难度: 简单查看答案及解析