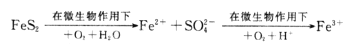-
下列按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合,正确的是
选项
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
Ca(OH)2
酒精
N2O5
Na2O
B
CaSO4
HIO
Mn2O7
CaO
C
NaHCO3
氨水
SO2
Al2O3
D
HCl
HF
CO2
Na2O2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关说法不正确的是
A. 空气中的臭氧含量高于10-4%会对人体健康造成伤害
B. 二氧化硫可用于制作葡萄酒的食品添加剂
C. 液氨罐泄漏时,可将其移入水塘中并加入生石灰
D. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
难度: 中等查看答案及解析
-
下列各组离子在指定环境中一定能大量共存的是
A. 常温下水电离出的c(OH-)=10-13mol/L的溶液中:Na+、ClO-、Cl-、K+
B. 与铝反应放出的氢气的溶液中:Na+、ClO-、SO42-、I-
C. 含有0.1mol/L Fe3+的溶液中:K+、Mg2+、S2-、NO3-
D. pH=13的溶液中:Na+、SO42-、S2-、NO3-
难度: 困难查看答案及解析
-
某实验小组为测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量Wg样品进行下列实验,下列实验方法所对应的是呀方案和测量数据不合理的是
选项
实验方法
实验方案
测量数据
A
滴定法
将样品配成100 mL溶液,取10 mL,加入甲基橙,
用标准盐酸滴定
消耗标准盐酸的体积
B
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增重
C
重量法
将样品与足量的盐酸反应后,所得的溶液,加热蒸发
所得固体的质量
D
重量法
将样品溶入水,滴加足量的CaCl2溶液,过滤、洗涤、
干燥所得的沉淀
所得沉淀的质量
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NA表示阿伏伽德罗常数,下列有关叙述正确的是
A. CH4与P4的分子结构都是正四面体形,因此在NA个CH4分子或P4分子中都含有4NA个共价键
B. 1mol FeI2与足量氯气反应时转移的电子数为2NA
C. 92g NO2和N2O4混合气体中含有的原子数为6NA
D. 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子
难度: 困难查看答案及解析
-
下列反应的离子方程式正确的是
A. NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B. 向次氯酸钙溶液通入SO2::Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
C. Fe(OH)3溶于氢碘酸:2Fe(OH)3+3H+= Fe3++3H2O
D. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 困难查看答案及解析
-
某无色溶液可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度均为0.1mol/L,往溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
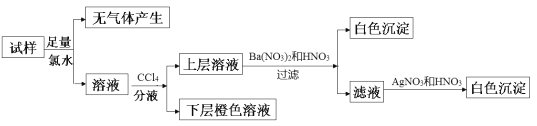
则关于原溶液的判断正确的是
A. 无法确定原溶液中是否存在Cl-
B. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
C. 若把Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
难度: 困难查看答案及解析
-
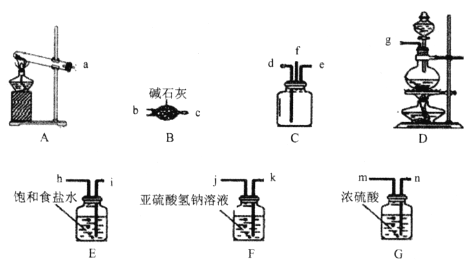
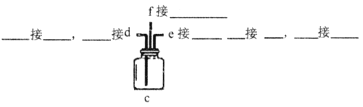
下列常用的四种仪器装置,其中使用方法不合理的是
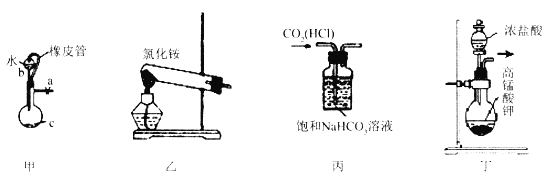
A. 装置甲:橡皮管的作用是使水顺利流下
B. 装置乙:实验室用于制取氨气
C. 装置丙:实验室除去二氧化碳中混有的氯化氢气体
D. 装置丁:实验室用于制取氯气
难度: 困难查看答案及解析
-
将甲和乙的混合气体通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
装置图
①
CO2
SO2
石灰水
②
CO2
NH3
CaCl2
③
HCl
CO2
石灰水
④
CO2
SO2
Ba(NO3)2
⑤
NO2
SO2
BaCl2
⑥
NH3
CO2
NaCl
A. ②③④ B. ①④⑤ C. ①③④⑤⑥ D. ①②③④
难度: 困难查看答案及解析
-
下列说法正确的是
A. 含有相同氧原子数的SO2和CO的质量之比为7:8
B. 等物质的量浓度的盐酸与醋酸中的c(H+)相等
C. 等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
D. 等温等压下,SO2气体与CO2气体的密度之比等于11:16
难度: 困难查看答案及解析
-
下列说法中正确的是
A. 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
B. 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
D. 滴定管、移液管在使用前要用待装润洗,而容量瓶不用待装液润洗
难度: 困难查看答案及解析
-
已知氮氧化物(可用NOx表示)能与NH3发生反应NOx+NH3→N2+H2O(方程式为配平)。现有NO、NO2的混合气体3L,用同温同压下3.6LNH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为
A. 1:1 B. 2:1 C. 1:3 D. 1:4
难度: 困难查看答案及解析
-
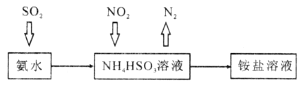
下列物质均有漂白作用,其漂白原理相同的是
①二氧化硫 ②漂白粉 ③过氧化钠 ④活性炭 ⑤浓硝酸 ⑥过氧化氢
A. ①②⑤⑥ B. ②③⑤⑥ C. ①②③④ D. ①④
难度: 困难查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A. Cl2与水反应生成HCl和HClO,推测F2与水反应生成HF和HFO
B. SiH4的沸点高于CH4,推测H2S的沸点高于H2O
C. NH3分子为三角锥型,推测PH3分子三角锥型
D. S与Fe反应生成FeS,推测S与Cu生成CuS
难度: 困难查看答案及解析
-
a mol FeS与b mol FeO投入到V L c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则在反应中未被还原的硝酸可能为
① (
)mol ②(a+b)×189 g ③(3a+3b)mol ④
mol
A. ②④ B. ②③ C. ①②③ D. ②③④
难度: 中等查看答案及解析