-
化学与生活、社会发展息息相关,下列说法正确的是( )
A. 加热能杀死流感病毒是因为蛋白质受热变性
B. 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理
C. “丹砂(HgS)烧之成水银,积变又成丹砂。”这个过程是可逆反应
D. 丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应
难度: 简单查看答案及解析
-
设NA为阿伏加徳罗常数的値,下列说法正确的是( )
A. 0.lmol的Na2O2含阴阳离子总数为0.4NA
B. 32g硫与足量金属铜反应转移电子数为NA
C. 标准状况下,11.2LNO与11.2LO2混合后其原子总数为2NA
D. 1LpH=1的硫酸溶液中,含有0.2NA个H+
难度: 中等查看答案及解析
-
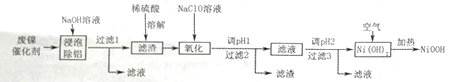
利用右图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
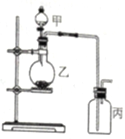
选项
实验目的
甲
乙
丙
A
制取并收集NO2
浓硝酸
铜片
水
B
制取并验证SO2具有漂白性
70%硫酸
亚硫酸钠
品红溶液
C
制取并验证氯气没有漂白性
浓盐酸
二氧化锰
干燥的红布条
D
比较HCl、H2CO3和H2SiO3酸性的强弱
盐酸
大理石
硅酸钠溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
B. 向 NaClO 溶液中通入过量SO2气体:ClO-+ H2O+SO2═HClO+HSO3-
C. 向偏铝酸钠溶液中加入碳酸氢钠:AlO2-+3HCO3-= Al(OH)3↓+ 3CO2↑
D. 向NH4HCO3溶液中加入过量NaOH溶液:NH4++HCO3-+2OH--=NH3·H2O+H2O+CO32-
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )

A. 该化合物的名称为乙酸乙酯
B. 该化合物既能发生水解反应,又能发生氧化反应
C. 该化合物与Br2的四氯化碳溶液不反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
难度: 中等查看答案及解析
-
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:

经一段时间后达到平衡,反应过程中测定的部分数据如下表所示:
时间/min
0
10
20
30
40
n(乙苯)/ mol
0.40
0.30
0.24
n2
n3
n(苯乙烯)/mol
0.00
0.10
n1
0.20
0.20
下列说法正确的是( )
A. 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B. 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L • min)
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆
难度: 困难查看答案及解析
-
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是( )
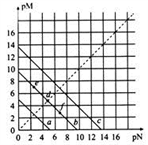
A. a线代表的是PbCO3
B. T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=3×10-5
C. d点可以代表CaCO3的饱和溶液,且c(Ca2+)= c(CO32-)
D. T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
难度: 困难查看答案及解析

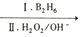 RCH2CH2OH;
RCH2CH2OH;