-
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性难度: 中等查看答案及解析
-
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内,3种气体AB、A2、B2物资的量相等
C.在恒容容器中,容器内压强不再变化
D.容器中各组分的体积分数不随时间变化难度: 中等查看答案及解析
-
下列各式中,属于正确的电离方程式的是( )
A.HCO3-+H2O⇌H2CO3+OH-
B.HCO3-+OH-=H2O+CO32-
C.NH3+H+=NH4+
D.NH3•H2O⇌NH4++OH-难度: 中等查看答案及解析
-
下列物质分类组合正确的是( )
A B C D 强电解质 HBr FeCl3 H2SO4 Ca(OH)2 弱电解质 HF HCOOH BaSO4 HI 非电解质 NH3 Cu H2O C2H5OH
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
反应2SO2+O2⇌2SO3,经一段时间后SO3的浓度增加了0.4mol•L-1,在这段时间内用O2表示的反应速率为0.4mol•L-1•s-1,则这段时间为( )
A.0.1s
B.2.5s
C.5s
D.10s难度: 中等查看答案及解析
-
反应FeO(s)+C(s)=Fe(s)+CO(g);△H>0,△S>0,下列说法正确的是( )
A.低温下自发进行,高温下非自发进行
B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行
D.任何温度下均为自发进行难度: 中等查看答案及解析
-
对于反应4A(s)+2B(g)⇌3C(g),下列说法正确的是( )
A.体积不变充入惰性气体,反应速率增大
B.其他条件不变,降低温度,反应速率减慢
C.其他条件不变时,增大压强,活化分子百分数增大,化学反应速率加快
D.若增加或减少A物质的量,反应速率一定会发生明显的变化难度: 中等查看答案及解析
-
某水溶液的pH是3,其中的c(OH-)是( )
A.0.1mol/L
B.1×10-3 mol/L
C.1×10-7 mol/L
D.1×10-11 mol/L难度: 中等查看答案及解析
-
向CH3COOH⇌CH3COO-+H+的平衡体系中,加入少量下列物质能使醋酸的电离程度和溶液的pH都变小的是( )
A.H2O
B.CH3COONa
C.NH3•H2O
D.H2SO4难度: 中等查看答案及解析
-
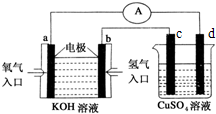
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,正确的是( )

A.此过程中铜被腐蚀
B.此过程中电子从Fe移向Cu
C.正极电极反应式为:2H++2e-═H2↑
D.铁钉表面发生的反应为Fe-3e-═Fe3+难度: 中等查看答案及解析
-
已知反应:①101kPa时,C(s)+
O2(g)═CO(g)△H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ/mol.
下列结论正确的是( )
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量难度: 中等查看答案及解析
-
下列有关电化学装置完全正确的是( )
A B C D 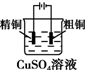
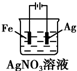
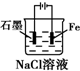
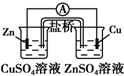
铜的冶炼 铁上镀银 防止Fe被腐蚀 构成铜锌原电池
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2⇌PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40mol
B.0.20mol
C.小于0.20mol
D.大于0.20mol,小于0.40mol难度: 中等查看答案及解析
-
化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,下列叙述中正确的是( )
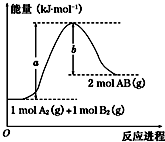
A.每生成2个分子AB吸收(a-b) kJ热量
B.该反应热△H=+(a-b)kJ•mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A和1mol B-B键,放出a kJ能量难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A.H+的物质的量
B.醋酸的电离常数
C.中和时所需NaOH的量
D.加足量锌粉产生氢气的量难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
从以上表格中判断以下说明不正确的是( )酸 HClO4 H2SO4 HCl HNO3 Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )物质 X Y Z 初始浓度/mol•L-1 0.1 0.2 平衡浓度/mol•L-1 0.05 0.05 0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y⇌2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数难度: 中等查看答案及解析
-
如图为对15mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,根据图象推出X(mol/L)和Y(mol/L)的物质的量浓度是下表内各组中的( )
选项 A B C D c(X)/mol•L-1 0.035 0.070 0.03 0.06 c(Y)/mol•L-1 0.070 0.035 0.06 0.03 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析