-
金属钠露置在空气中会发生一系列变化,其中产物不可能是( )
A.Na2O2 B.NaOH C.Na2CO3·10H2O D.Na2CO3
难度: 中等查看答案及解析
-
若某溶液由水电离产生的c(OH-)=1.0×l0-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、NO3-、Cl-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+ H2SO4= SO2↑+ O2 ↑+2H2O D.2Fe3++2I-=2Fe2++I2
难度: 中等查看答案及解析
-
下列关于镁铝化学性质的表述不正确的是( )

难度: 中等查看答案及解析
-
将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4溶液 ③饱和澄清石灰水 ④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤⑥
难度: 中等查看答案及解析
-
甲和乙两烧杯中各装有100mL0.2mol/LAlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成.下列判断正确的是( )
A.实验过程中甲中和乙中的现象始终保持一致 B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的多 D.乙中沉淀可能比甲中的多
难度: 困难查看答案及解析
-
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,反应的化学方程式为2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
A.反应中KMnO4被氧化
B.HCl发生还原反应
C.每消耗2mol HCl时,反应中转移的电子为2 mol
D.氧化剂与还原剂的物质的量之比为1﹕5
难度: 中等查看答案及解析
-
亚硝酸(HNO2)既有、可作氧化剂又可作还原剂,当亚硝酸在反应中作氧化剂时,可能生成的产物是( )
A.N2 B.N2O3 C.NH3 D.NO2
难度: 中等查看答案及解析
-
关于碱金属单质的性质叙述正确的是( )
A. 在空气中燃烧都能生成过氧化物
B. 与盐酸溶液反应时都能生成碱和氢气
C. 熔沸点随原子序数增加而升高
D. 还原性随原子电子层数的增加而增加
难度: 中等查看答案及解析
-
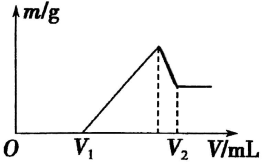
在一密闭容器中有HCHO、 H2和O2混合气体共20 g,放入足量Na2O2用电火 花引燃,使其完全反应,Na2O2增重8g,则原混合气体中HCHO、H2和O2的质量比可能是( )
A.1:3:6 B.2:1 :6 C.3 : 5 : 12 D.1:1 :6
难度: 困难查看答案及解析
-
下列有关实验的说法正确的是( )
A.将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体
B.钠与乙醇反应比与水反应要剧烈得多
C.除去苯中的苯酚可采用加入足量的NaOH溶液后分液的方法
D.除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化
难度: 中等查看答案及解析
-
为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是( )
A.分别取样配成溶液,分别往两份溶液中逐滴滴加几滴稀盐酸,一开始就有气体产生的为NaHCO3
B.分别取样加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,直接观察火焰的颜色
难度: 中等查看答案及解析