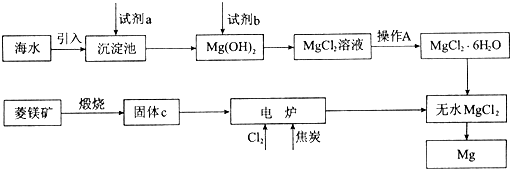
-
下列物质不属于天然高分子化合物的是( )
A.淀粉
B.蔗糖
C.蛋白质
D.纤维素难度: 中等查看答案及解析
-
下列电子式不正确的是( )
A.H:Cl
B.
C.
D.难度: 中等查看答案及解析
-
月球上含有丰富的
He.下列关于
He的说法不正确的是( )
A.是一种核素
B.原子核内有l个中子
C.与He互为同位素
D.比He少一个电子
难度: 中等查看答案及解析
-
下列关于基本营养物质的说法不正确的是( )
A.淀粉在人体内最终水解为葡萄糖
B.蛋白质在人体内最终水解为氨基酸
C.纤维素在人体内最终水解为葡萄糖
D.油脂在人体内最终水解为甘油与高级脂肪酸难度: 中等查看答案及解析
-
“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是( )
A.风力发电,让能源更清洁
B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康
D.环保涂料,让环境更宜居难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.化学键是使离子或原子相结合的作用力
B.气态单质分子中不一定存在化学键
C.NaCl与NaOH固体中的化学键类型完全相同
D.碳原子最外层有4个电子,能与其他原子形成4个共价键难度: 中等查看答案及解析
-
下列关于化学与生产、生活的认识不正确的是( )
A.二氧化硫、二氧化氮和二氧化碳都是形成酸雨的物质
B.用高锰酸钾溶液吸收水果产生的乙烯,能达到保鲜的目的
C.金属锂是最轻的金属,且活动性强,是制造电池的理想物质
D.含氮、磷的大量污水任意排放是造成水华、赤潮等水体污染的重要原因难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CH4能使酸性KMnO4溶液褪色
B.金属Na能置换CH3CH2OH甲基中的氢生成H2
C.乙酸有强烈的刺激性气味,其水溶液称为冰醋酸
D.CH3CH2CH2CH3与互为同分异构体
难度: 中等查看答案及解析
-
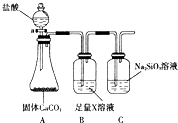
如图所示实验装置或操作不符合实验要求的是( )
A.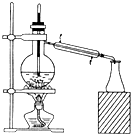
石油分馏
B.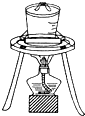
灼烧干海带
C.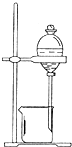
用CCl4提取碘水中的碘
D.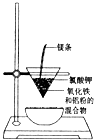
冶炼金属铁难度: 中等查看答案及解析
-
硒(Se)是人体必需的微量元素,在元素周期表中的位置如图.下列关于硒元素的叙述正确的是( )
A.位于元素周期表第四周期第ⅣA族
B.原子序数为34
C.H2Se比HBr稳定
D.最高价氧化物的化学式是SeO2难度: 中等查看答案及解析
-
下列关于资源综合利用和环境保护的化学方程式不正确的是( )
A.海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O=2HBr+H2SO4
B.将煤气化为可燃性气体:C(s)+H2O(g)CO(g)+H2(g)
C.用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3
D.燃煤时加入CaCO3脱硫:2CaCO3+2SO2+O22CaSO4+2CO2
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次递增的4种短周期元素.其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强.下列说法正确的是( )
A.X、Y与Z 3种元素组成的化合物中阴、阳离子所含电子数不等
B.X与Z为同主族元素,它们的单质与W单质反应均失去电子
C.Y与Z的单质在常温下反应生成Z2Y2
D.Y、Z与W 3种元素组成的某种化合物可用于消毒难度: 中等查看答案及解析
-
工业制硫酸的反应之一是:2SO2+O2
2SO3.如果反应在密闭容器中进行,下列说法错误的是( )
A.当SO2的物质的量不再改变时,该反应达到了平衡状态
B.达到平衡时,SO2的浓度与SO3的浓度一定相等
C.在给定条件下达平衡时,SO2的转化率达到了最大
D.使用V2O5催化剂是为了加快反应速率,提高生产效率难度: 中等查看答案及解析
-
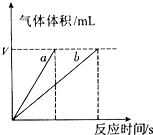
印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、
,其中HClO2是漂白剂的有效成分,ClO2是有毒气体.各组分含量随pH变化如图所示,由图可知,使用该漂白剂的最佳pH为( )
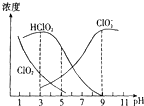
A.3.0
B.4.0~4.5
C.6.5~7.0
D.9.0难度: 中等查看答案及解析
-
下列实验结论不正确的是( )
实验操作 现象 结论 A 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 溶液褪色 产物不都是烷烃 B 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 橙色溶液变为绿色 乙醇具有还原性 C 将碘酒滴到土豆片上 土豆片变蓝 淀粉遇碘元素变蓝 D 将新制Cu(OH)2与葡萄糖溶液混合加热 产生红色沉淀(Cu2O) 葡萄糖具有还原性
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列关于金属的冶炼方法叙述不正确的是( )
金属 存在形式 冶炼方法 A 金 游离态 金子比沙子密度大,利用水洗法直接分离 B 银 化合态 银的金属性弱,用加热Ag2O的方法冶炼 C 铁 化合态 铝的金属性比铁强,可用铝热法炼铁 D 钠 化合态 钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和NaCl溶液方法冶炼
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列事实能说明氯元素的非金属性比硫元素强的是( )
①还原性:Cl-<S2-
②Cl2能与H2S反应生成S
③HClO4的酸性比H2SO4的强
④常温下Cl2是气体,S是固体.
A.①②③
B.①②④
C.①③④
D.②③④难度: 中等查看答案及解析
-
某孔雀石的主要成分为CuCO3•Cu(OH)2,可用来冶炼铜.孔雀石与焦炭混合加热时,可生成铜、二氧化碳和水.下列说法不正确的是( )
A.将孔雀石粉碎后与焦炭混合加热,是为了加快反应速率
B.1molCuCO3•Cu(OH)2与足量焦炭反应转移2mol电子
C.1molCuCO3•Cu(OH)2最多能与2molH2SO4反应
D.根据孔雀石样品的质量和其与足量硫酸反应产生CO2的体积(标准状况),即可测得样品中Cu的质量分数(假定其他成分不与酸反应)难度: 中等查看答案及解析
-
将6.72L(标准状况)乙烯与乙烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.8g,则原气体混合物中乙烯与乙烷的物质的量之比是( )
A.1:2
B.2:1
C.1:3
D.3:1难度: 中等查看答案及解析
-
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是( )
元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.075 0.102 0.074 主要化合价 +2 +3 +5、+3 +6、-2 -2
A.离子半径:L2+>T2-
B.氢化物的还原性:H2T>H2R
C.M与T形成的化合物只能与盐酸反应,不与NaOH溶液反应
D.一定条件下,T的单质可将Q从其氢化物中置换出来难度: 中等查看答案及解析
-
下列关于苯的叙述正确的是( )

A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键难度: 中等查看答案及解析