-
用实验室制溴苯的废催化剂FeBr3作原料,制取溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
A.用装置甲制取氯气
B.用装置乙氧化FeBr3溶液中的溴离子
C.用装置丙分液时先从下口放出水相,再从上口倒出有机相
D.用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3
难度: 中等查看答案及解析
-
化学与社会可持续发展密切相关。下列做法不合理的是
A. 发展风能、太阳能发电 B. 推广煤液化、气化技术
C. 提倡聚碳酸酯可降解塑料的使用 D. 普及汞锌锰干电池的使用
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. Al3+的结构示意图:
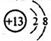
B. HC1O的电子式:

C. 中子数为117、质子数为116的Lv原子:
Lv
D. HOCH2COOH 缩聚物的结构简式:
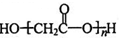
难度: 中等查看答案及解析
-
汽车安全气囊弹出时的反应为:10NaN3+2KNO3+6SiO2
5Na2SiO3+K2SiO3+16N2↑。下列说法正确的是
A. 自然界中氮、钠、硅元素均可以游离态形式存在
B. 将反应后的固体溶于适量水,静置,通入CO2,无现象
C. 微粒的半径:r(K+)>r(Na+)>r(O2-)
D. 若反应中转移6.02×1022电子,则消耗NaN3的质量为6.5g
难度: 中等查看答案及解析
-
右下表为元素周期表短周期的一部分,其中X元素的原子内层电子数是最外层电子数的一半。下列有关X、Y、Z、W、Q五种元素的叙述中,不正确的是
X
Y
Z
W
Q
A. X与Y形成的阴离子有XY32-、X2Y42-
B. Y分别与Z、W形成的化合物中化学键类型相同
C. Q与Y可形成一种高效安全灭菌消毒剂
D. W的最高价氧化物对应水化物的酸性比Q的弱
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Cl2溶于水:C12+H2O
2H++Cl-+C1O-
B. 用稀硝酸除去试管内壁的银镜:Ag+4H++NO3-==Ag++NO↑+2H2O
C. 过量SO2通入饱和的Ca(C1O)2溶液中:
Ca2++2ClO-+2SO2+2H2O=CaSO4↓+SO42-+4H++2Cl-
D. (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-
NH3↑+Fe(OH)2↓+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 铁制水闸门常与直流电源的正极相连,可防止其腐蚀
B. 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
D. 一定温度下,CH3COOH稀溶液中加入少量的冰醋酸,溶液中
 增大
增大难度: 中等查看答案及解析
-
煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g) =CO2(g)+2H2(g);△H1= 90.1kJ•mol-1
②催化液化I:CO2(g)+3H2(g)= CH3OH(g)+H2O(g) ;△H2= -49.0kJ•mol-1
③催化液化II:CO2(g)+2H2(g)=H3OH(g)+
O2(g) ;△H3= akJ•mol-1
A. 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小
B. 反应C(s)+H2O(g) +H2(g)=CH3OH(g) △H= 41.1 kJ•mol-1
C. △H2>△H3
D. 右图为甲醇燃料电池的工作原理,负极的电极反应为: CH3OH-6e-+6OH-= CO2+5H2O
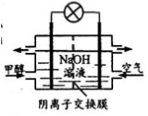
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A.

B.

C.

D.

难度: 中等查看答案及解析
-
下列图示与对应的叙述相符合的是
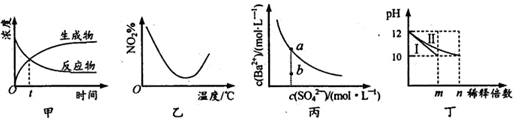
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 • H2O溶液,n>100
难度: 中等查看答案及解析
-
化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法正确的是
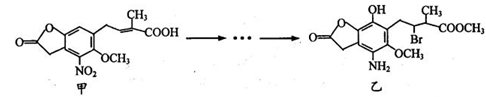
A. 甲的分子式为C14H14NO7 B. 甲、乙中各有1个手性碳原子
C. 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 D. 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应
难度: 中等查看答案及解析
-
硫铁矿焙烧后的烧渣含有Fe2O3、FcO、SiO2、Al2O3,用过量硫酸浸取,过滤,将滤液分别与下列指定物质反应,所得溶液中主要存在的一组离子正确的是
A. 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42-
B. 过量SO2:Fe2+、H+、Al3+、SO42-
C. 过量氨水:NH4+、AlO2-、SO42-、OH-
D. 过量 Na2O2:Na+、Fe3+、SO42-、OH-
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变澄清
CO32-结合质子的能力比C6H5O-弱
B
向NaHS溶液中滴入酚酞,溶液变红色
HS-水解程度大于电离程度
C
向废FeCl3蚀刻液X中加入少量的铁粉,振荡,未出现红色固体
X中一定不含Cu2+
D
在CuSO4洛液中加入KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色
Cu2+有氧化性,白色沉淀可能为 CuI
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100 mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如右下图所示。下列说法正确的是
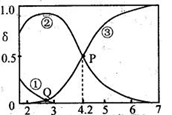
A. 0.100 mol•L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
C. P点:c(Na+)+ c(H2C2O4)< 0.100 mol•L-1+c(HC2O4-)
D. 该温度下H2C2O4的电离平衡常数Ka2=1×10-4.2 mol•L-1
难度: 中等查看答案及解析
-
汽车尾气净化器中发生的反应为2NO(g)+2CO(g)
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器
温度/(℃)
起始物质的量(mol)
平衡物质的量(mol)
NO
CO
N2
CO2
N2
CO2
I
400
0.2
0.2
0
0
0.12
II
400
0.4
0.4
0
0
III
300
0
0
0.1
0.2
0.075
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 mol•L-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
难度: 中等查看答案及解析

 。
。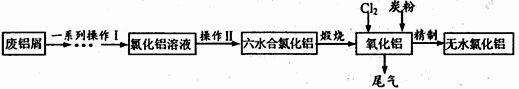
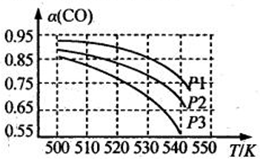

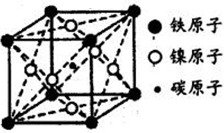

 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________________________________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________________________________