-
铬的化合物有广泛应用。根据国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0 10-7mol·L-1以下才能排放。
10-7mol·L-1以下才能排放。
(1)含CrO42-的废水处理通常有以下两种方法。
①沉淀法:先加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)= 1.2 10-10],再加入可溶性硫酸盐处理多余的Ba2+。为使废水处理后CrO42-浓度达到国家排放标准,则加入可溶性钡盐后的废水中应使Ba2+的浓度不小于________ mol·L-1。
10-10],再加入可溶性硫酸盐处理多余的Ba2+。为使废水处理后CrO42-浓度达到国家排放标准,则加入可溶性钡盐后的废水中应使Ba2+的浓度不小于________ mol·L-1。
②还原法: 。
。
若1L废水中含铬元素的质量为28.6g,酸化时CrO42-有10/11转化为Cr2O72-,CrO42-转化为Cr2O72-的离子方程式为_____________________________;酸化后所得溶液中c(Cr2O72-)=____________。
(2)将KCl和CrCl3两种固体混合物共熔制得化合物X。通过下列实验确定X的组成:
I .取ag化合物X,先将X中Cr元素全部氧化成Cr2O72-,再配成500.00mL溶液;
II.毎次量取25.00mL该溶液,然后用0.4000 mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,实验数据记录如下;
| 实验数据 实验序号 | (NH4)2Fe(SO4)2溶液体积读数/mL |
| 滴定前 | 滴定后 |
| 第一次 | 0.30 | 15.31 |
| 第二次 | 0.20 | 15.19 |
| | |
另取ag化合物X,配成溶液,加入过量的AgNO3溶液,可得25.83gAgCl沉淀。
通过计算确定化合物X的化学式(写出计算过程)。_________________________
-
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是________。
(2)阴极附近溶液pH升高的原因是_________(用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
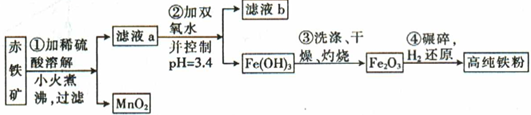
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是________,pH控制在3.4的作用是________,已知25℃时,Ksp[Cu(OH)2] =2.0 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K=________。
Cu(OH)2+2H+的平衡常数K=________。
(4)如何判断步骤③中沉淀是否洗涤干净?________。
(5)制备氮化铁磁粉的反应:Fe+NH3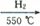 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2 kg,设整个过程中无损耗,则FexNy磁粉的化学式为________________。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2 kg,设整个过程中无损耗,则FexNy磁粉的化学式为________________。
-
铁是地壳中含量第二的金属元素,其单质、合金化合物在生产生活中的应用广泛。
(一)工业废水中有一定量的Cr2O72--和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是____________________________________________________。
(2)阴极附近溶液pH升高的原因是___________(用电极反应式解释);溶液中同时生成的沉淀还有___________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁涉及的主要生产流程如下:
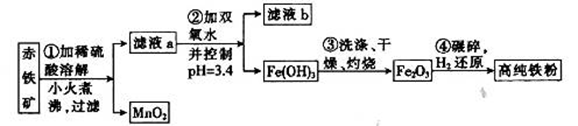
已知:①某赤铁矿石含60.0 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:

(3)步骤②中加双氧水的目的是__________________,pH控制在3.4的作用是_______________________;已知25℃时,Ksp[Cu(OH) 2] =2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。
(4)如何判断步骤③中沉淀是否洗涤干净?_____________________________________。
-
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

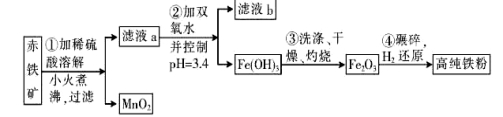
已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时,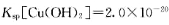 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应: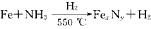 (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
-
来源于电镀、冶金等行业的含六价铬(含Cr2O72-或CrO42-)废水具有很强的生物毒性,因此,含铬废水必须严格控制六价铬的质量浓度,达标后才能允许排放。一种处理含铬酸性废水的工艺如图所示:

回答下列问题:
(1)去除铁屑表面油污的方法是__。
(2)酸性环境中,废水中主要存在大量Cr2O72-和少量CrO42-,原因是__(用化学用语和文字表述解释)。
(3)向“铁屑滤池"中加入碳粒料的作用是__;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为__。
(4)向“反应池"中加入NaOH使Cr3+沉淀,池中存在沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
(5)①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,画出电解池的装置示意图并标出电极和电解质溶液的名称___(可选电极:Fe和石墨)。

②上述装置中,阳极的电极反应式为__。
-
铬及其化合物在工业上有着广泛的用途,但在生产和使用过程中易产生有毒害的含铬工业废水。
I.处理含铬工业废水的常用方法是还原沉淀法,该方法的工艺流程如下:
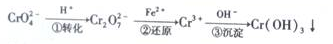
(l)上述流程的步骤①中存在如下平衡:2CrO42-(黄色)+2H+ Cr2072一(橙色)+H20。若平衡体系的pH =0时,溶液的颜色为_________色。
Cr2072一(橙色)+H20。若平衡体系的pH =0时,溶液的颜色为_________色。
(2)第②步反应的离子方程式为 ,步骤③可通过调节第二步反应后溶液的pH使Cr3+沉淀完全,请通过计算判断当pH >6时,溶液中Cr3+是否沉淀完全:。(简要写出计算过程。已知常温下,Cr( OH)3的溶度积Ksp=6.0 x10一31,且当溶液中离子浓度小于10 -5mol.L-l时可视作该离子不存在。)
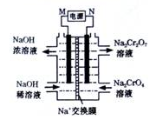
(3)以石墨为电极电解Na2CrO4溶液制取Na2Cr207,电解装置如下图所示。直流电源M极的电极名称是_________,和N相连的一极的电极反应式为_____________。
Ⅱ.Cr03俗称铬酸酐,常用于制备铬的化合物。Cr03具有强氧化性,热稳定性较差。
(4)Cr03具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。在硫酸酸化时Cr03可将乙醇氧化成乙酸,而Cr03被还原成绿色的硫酸铬[Cr2(S04)3]。则该反应的化学方程式为 。
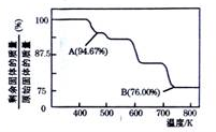
(5)Cr03的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如右图所示。请根据图示信息写出从开始加热到750K时总反应的化学方程式____ 。
-
铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:

请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH- 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 甲 | 4 | 60 | 10 | 30 |
| 乙 | 5 | x | 10 | 30 |
| 丙 | 5 | y | 5 | z |

(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
-
铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I、还原沉淀法是处理含Cr2O42— 和CrO72—工业废水的一种常用方法,其工艺流程如下:
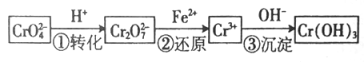
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
(1)若平衡体系中,pH=0时溶液显 色。
(2)以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图所示。
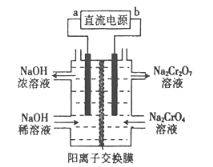
a极的名称是 ;b极直接相连一极的反应式为 。
(3)第②步反应的离子方程式: 。
第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38 mol·L—1,Ksp[Cr(OH)3]=6.0x10—31 mol·L—1)。
II、探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b:c:f= 。
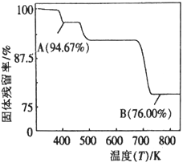
(5)CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图所示。B点时生成固体的化学式为 。(固体残留率=  )
)
-
(15分)铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72— 和CrO42—工业废水的一种常用方法,其工艺流程为:
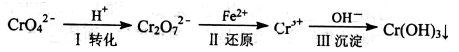
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显 色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
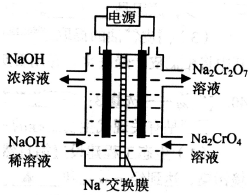
③第Ⅱ步反应的离子方程式: ,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
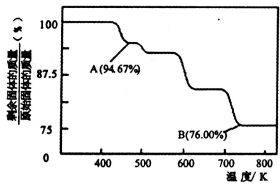
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:

(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是 (填化学式)。
-
还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下:CrO42- Cr2O72-
Cr2O72-
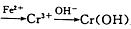 ,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下
,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下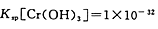 。有关叙述中不正确的是
。有关叙述中不正确的是
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+
C.处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水
D.当pH≥5时,废水中铬元素沉淀完全
10-7mol·L-1以下才能排放。
10-10],再加入可溶性硫酸盐处理多余的Ba2+。为使废水处理后CrO42-浓度达到国家排放标准,则加入可溶性钡盐后的废水中应使Ba2+的浓度不小于________ mol·L-1。
 。
。

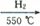 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2 kg,设整个过程中无损耗,则FexNy磁粉的化学式为________________。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2 kg,设整个过程中无损耗,则FexNy磁粉的化学式为________________。



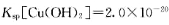 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O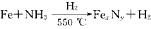 (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为
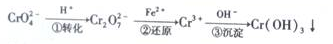






 )
)
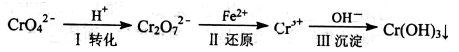



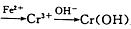 ,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下
,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下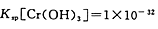 。有关叙述中不正确的是
。有关叙述中不正确的是