-
今年国际化学年的主题是“化学—我们的生活,我们的未来”。下列说法不正确的是
A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。PM2.5被吸入人体后会直接进入支气管,易引发包括哮喘、支气管炎和心血管病等方面的疾病
B.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
C.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料
D.生物柴油的主要成分是利用从泔水中提取的地沟油与甲醇反应生成的脂肪酸甲酯类化合物,与石化柴油有本质不同
难度: 简单查看答案及解析
-
分类在科学研究中必须用的方法,下列关于化学的分类说法正确的是
A.干冰、HD均为化合物;水玻璃、水银均为混合物;纯碱和生石灰分别属于碱和氧化物;蔗糖、PVC、淀粉都是高分子化合物
B.根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等
C.由于饱和碳酸钙的导电性比饱和氨水的导电性弱,所以碳酸钙是弱电解质
D.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
难度: 简单查看答案及解析
-
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是 ( )
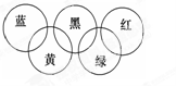
蓝
黄
黑
绿
红
A
SiO2
NaOH溶液
CuSO4溶液
Ag
O2
B
O2
Fe
稀H2SO4
NaOH溶液
CO2
C
O2
NH3
稀H2SO4
NaOH溶液
Al(OH)3
D
Mg
Al
CO2
Fe2O3
KOH溶液
难度: 中等查看答案及解析
-
近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是
A.运石油的油罐车上应贴
 标志,装运浓硫酸的槽罐车应贴
标志,装运浓硫酸的槽罐车应贴 标志,并由专人押运
标志,并由专人押运B.欲往燃烧的酒精炉中添加酒精必须要先熄灭酒精炉并等酒精炉完全冷却后才能加入酒精。
C.炒菜时油锅着火,立即加水灭火;电器起火时,应立即切断电源并采取适当措施灭火。
D.若家中出现煤气泄露,会闻到浓烈的气味,应马上开窗通风,切不可打电话或打开其他电器。
难度: 简单查看答案及解析
-
下列说法错误的是
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小
C.化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热
D.凡经加热而发生的化学反应都是吸热反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.Cl2通入FeSO4溶液中 B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中 D.SO2通入BaCl2溶液中
难度: 简单查看答案及解析
-
下列反应所得溶液中一定只含一种溶质的是
A.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
B.向稀硝酸中加入铁粉
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向NaOH溶液中通入CO2气体
难度: 中等查看答案及解析
-
氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为BrCl+ H2O = HCl+ HBrO关于BrCl叙述错误的是:( )
A.固态溴化碘是由极性键构成的分子晶体 B. 和NaOH溶液反应生成NaCl和NaBrO
C.能使湿润的淀粉碘化钾试纸变蓝 D.与水反应时BrCl既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
下列关于离子共存的评价及离子方程式书写正确的是
选项
离子组
评价
A
H+、Mg2+、Br-、NO3-
能大量共存于同一溶液中,投入少量锌粉后,可放出H2 ,反应的离子方程式为 Zn+ 2H+ = Zn2++ H2↑
B
NH4+、CO32-、Cl-、Al3+
不能大量共存于同一溶液中,因为有沉淀生成
2Al3++3CO32-=Al2(CO3)3↓
C
ClO-、Na+、K+、HSO3-
能大量共存于同一溶液中
D
HCO3-、OH-、Na+、K+
不能大量共存于同一溶液中,因为发生如下反应
HCO3-+ OH-= CO32-+ H2O
难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是
A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3- +2OH- = CaCO3↓+2H2O+CO32-
B.氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++ OH- +H+ +SO42- = BaSO4↓+H2O
C.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3- == CaCO3↓+H2O
D.向溴化亚铁溶液中通入过量氯气:2Fe2+ + 4Br— + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl—
难度: 中等查看答案及解析
-
下列表格中的各种情况,可以用下面的图象曲线表示的是
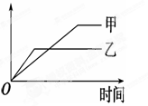
反应
纵坐标
甲
乙
A
等质量的钾、钠分别与足量水反应
H2质量
钠
钾
B
相同质量氨,在同一容器中2NH3
N2+3H2
氨气的转化率
500℃
400℃
C
在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3
N2+3H2
氨气的浓度
活性高的催化剂
活性一般的催化剂
D
2molSO2与1molO2,在相同温度下2SO2+O2
2SO3
SO3物质的量
10个大气压
2个大气压
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如下图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是
A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
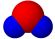
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
难度: 中等查看答案及解析
-
有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验。(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液(2)加热试管中的白色粉末,试管口有水滴凝结(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物。下列混合物中符合以上实验现象的是
A.NaHCO3、AgNO3 B.BaCl2、MgCO3
C.NH4HCO3、MgCl2 D.CaCl2·6H2O、Na2CO3
难度: 中等查看答案及解析
-
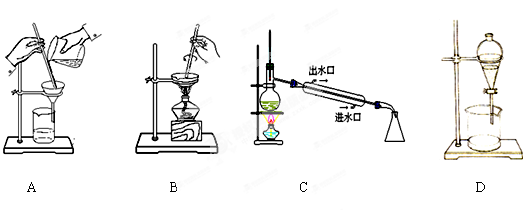
欲提纯含有少量Ba(NO3)2杂质的KNO3溶液,需使用的装置为( )
难度: 简单查看答案及解析
-
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
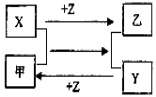
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
难度: 中等查看答案及解析
-
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,不正确的是
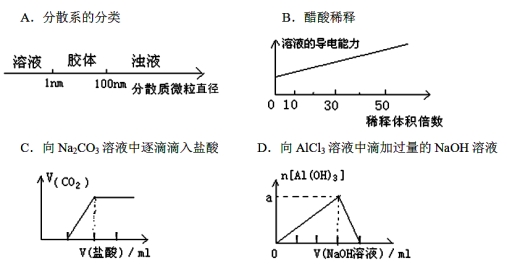
难度: 中等查看答案及解析
-
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供。因其独特的放电方式,也称呼吸式电池。负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液。中间设有用于隔开正极和负极的锂离子固体电解质。正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合。如图所示。下列说法不正确的是
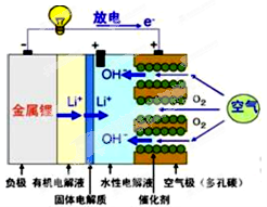
A.负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线。溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中。
B.正极反应:O2+2H2O+4e- =4OH- ,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环。
C.在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应。
D.锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止。
难度: 困难查看答案及解析
-
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
CH3OCH3(g)+H2O(g),则下列说法正确的是
容器
编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
A、该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
难度: 中等查看答案及解析
-
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下 ( )
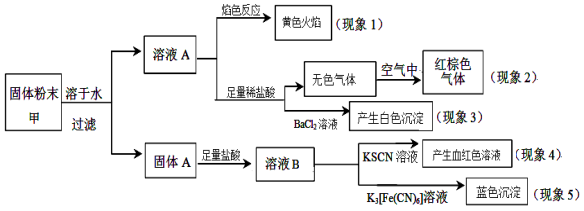
该同学得出的结论正确的是
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
难度: 困难查看答案及解析
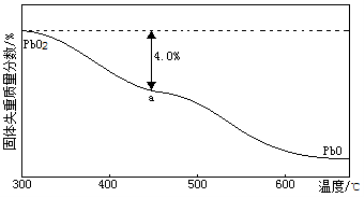
 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_