-
为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
A.②④ B.①②⑤ C.③④⑤ D.②③
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.工业上生产硫酸的过程中,二氧化硫在接触室氧化时通入过量空气(O2)
D.工业合成氨时常用通过量氮气的方法提高氢气的转化率
难度: 中等查看答案及解析
-
在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
难度: 简单查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①外电路中,电流由铜电极流向银电极
②正极反应 为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.②④ B.②③ C.①② D.③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.醋酸溶液中滴入石蕊呈红色,证明醋酸是弱电解质
B.液态HCl不导电,证明HCl是共价化合物
C.饱和石灰水中加入少量CaO,恢复至原温,溶液的pH增大
D.向Na2CO3溶液中加入少量NaOH固体,抑制CO32-水解,溶液pH减小
难度: 中等查看答案及解析
-
在0.1mol·L-1的HCN溶液中存在如下电离平衡HCN
H++CN-,对该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1mol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量NaCN固体,平衡向正反应方向移动
难度: 简单查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.升高温度,该反应平衡常数K一定增大
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O,可提高CO2和H2的利用率
难度: 中等查看答案及解析
-
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L, 工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,
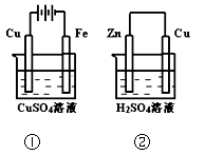
则
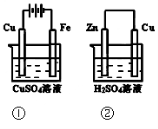 下列叙述正确的是
下列叙述正确的是A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一-4e一=2H2O+O2↑;②中负极:2H+ + 2e-= H2↑
D.溶液的pH:①不变;②增大
难度: 中等查看答案及解析
-
下列关于电解质溶液中离子数目的判断正确的是
A.0.1L 3.0mol/L的NH4NO3溶液中含有的NH4+的数目为0.3NA
B.等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA
C.0.1mol/L的NaHSO4溶液中,阳离子的数目之和为0.2NA
D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA
难度: 中等查看答案及解析
-
关于25℃时,pH = 12的NaOH溶液,下列说法错误的是
A.c(OH-) =c(Na+) + c(H+)
B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1
C.与等体积pH = 2的醋酸混合后所得溶液显碱性
D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中: c(Na+)> c(NH4+)
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项
x
y
A
MgSO4的质量(忽略体积)
CO的转化率
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
温度
容器内混合气体的密度
难度: 困难查看答案及解析
-
已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11 mol·L-1
难度: 中等查看答案及解析
-
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是
A.在水中的溶解能力大于 CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是
①无色溶液中:K+、Na+、HCO3-、Al3+
②pH=11的溶液中:Na+、Ba2+、AlO2-、OH-
③水电离出的c(H+) =10-12mol·L-1的溶液中:Mg2+、NH4+、HCO3-、S2-
④加入Al放出H2的溶液中:Cu2+、NH4+、Cl-、NO3-
⑤无色溶液中:K+、Na+、CO32-、SO42-
⑥酸性溶液中:Ca2+、NO3-、Cl-、I-
A.①④ B.④⑥ C.②⑤ D.②③
难度: 困难查看答案及解析
-
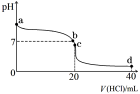
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
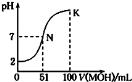
A.HA为一元强酸,MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.K点所示溶液中c(A-)>c(M+)
D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中
减小
C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
难度: 中等查看答案及解析