-
(16分)
| 化学式 | NH3·H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(1)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-) c(K+)-c(CH3COO-)。(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。
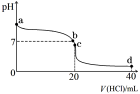
⑤NH4HCO3溶液呈 性(填“酸”、“碱”或 “中”)。
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。
-
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。
-
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
-
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0–5 | 4.9×l0–10 | K1=4.3×l0–7 K2=5.6×l0–11 | 1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO- 、CN- 、CO32-结合质子(即H+)的能力大小顺序__________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为
(4)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲﹕c(OH-)乙 10(填“>”、“=”或“<”)。
-
电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
| 弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Kb = 1.8×10 −5 | Ka = 1. 77×10 −4 | Ka=4.3×10−10 | Ka1=5.0×10−7 Ka2=5.6×10−11 |
① 已知25℃时,HCOOH( aq) +OH −( aq)=HCOO−(aq) +H2O(l) △H=−a kJ/mol H+(aq) +OH−(aq) =H2O(l) △H=−b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN−)______c(HCO3 −)(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2−) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
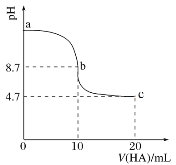
① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 mol•L-1NaOH和n mol•L-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
-
部分弱电解质的电离平衡常数如下表,以下选项错误的是
| 化学式 | NH3·H2O | CH3COOH | HCN | H2CO3 |
| Ki(25℃) | 1.8×l0—5 | 1.8×l0—5 | 4.9×l0—10 | Ki1= 4.3×l0—7 Ki2= 5.6×l0—11 |
A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性
C.CN-+H2O+CO2→HCN+ HCO3-
D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者
-
已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
-
已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)

