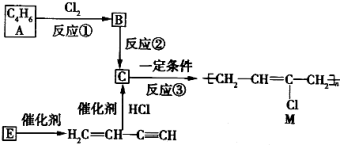
-
化学与生产、生活、社会密切相关。下列说法中不正确的是
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害
D.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述中,正确的是
A.煤油是石油的分馏产品,可用于保存少量金属钠
B.肥皂可以通过高分子化合物油脂发生皂化反应制得
C.鸡蛋清中加入CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水
D.淀粉、纤维素完全水解的产物互为同分异构体,且都可与新制氢氧化铜反应
难度: 中等查看答案及解析
-
下列关于甲、乙、丙、丁四个图像的说法中,正确的是

A.图甲表示向乙酸溶液中通入氨气,此过程中溶液导电性的变化
B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
C.图丙表示25℃时,用0.1 mol/L盐酸滴定20mL 0.1 mol/L氨水,溶液的pH随加入盐酸体积的变化
D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
难度: 中等查看答案及解析
-
下列说法正确的是
A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子
B.构成单质的分子中一定含有共价键
C.溶液和胶体的本质区别是有无丁达尔效应
D.化学变化不产生新元素,产生新元素的变化不是化学变化
难度: 中等查看答案及解析
-
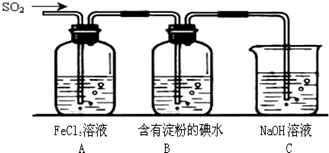
下列药品和装置合理且能完成相应实验的是

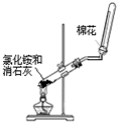
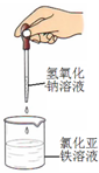

A B C D
A.喷泉实验 B.实验室制取并收集氨气
C.制备氢氧化亚铁 D.验证苯中是否含有碳碳双键
难度: 中等查看答案及解析
-
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
A. pH=1和pH=2的盐酸,c(H+)之比为1:2
B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O
C. pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小
D. pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同
难度: 中等查看答案及解析