-
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是
A.某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨
B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C.高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应
D.人造纤维,合成纤维和光导纤维都是有机高分子化合物
难度: 简单查看答案及解析
-
下列工业生产的主要反应中,涉及置换反应的是
A.生产粗硅 B.海水提镁
C.电解冶铝 D.生产硫酸
难度: 简单查看答案及解析
-
下列叙述正确的是
A.H2与T2互为同位素
B.SO2、CO均属于酸性氧化物
C.离子化合物中一定不含共价键
D.氯化铵、氯化氢都属于强电解质
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA
B.18gD2O中含有的质子数目为10NA
C.常温常压下,1mol氦气中含有的核外电子数为2NA
D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA)L
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Na与水反应Na+H2O=Na++OH-+H2↑
B.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+3H+
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-=SiO32-+H2O
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O+CO32-
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.SiO2和NO2能与强碱溶液反应,都是酸性氧化物
B.不锈钢材料因含有铬、镍所以抗腐蚀性好
C.普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐
D.MgO和Al2O3熔点较高都可以做耐火材料,都能和强碱溶液反应
难度: 简单查看答案及解析
-
现有Na2CO3、H2SO4、Ba(OH)2三种物质的物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液
A.一定呈酸性 B.不可能呈碱性
C.可能呈中性或碱性 D.一定呈中性
难度: 困难查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
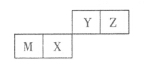
A.元素形成的简单离子的半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的强
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期、第ⅥA族
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe3+、NO3-、SO42-、Na+
B.使酚酞变红色的溶液中:Na+、Al3+、HCO3-、NO3-
C.能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl-
D.无色透明的溶液中:K+、Cu2+、Cl-、NO3-
难度: 中等查看答案及解析
-
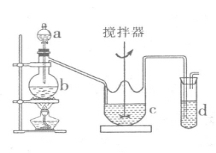
关于下列各装置的叙述正确的是
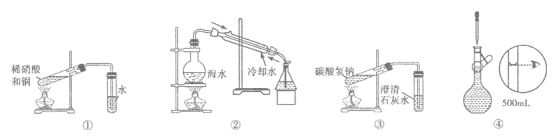
A.装置①可用于实验室制备NO气体
B.装置②可用于模拟海水蒸馏
C.装置③可用于探究碳酸氢钠的热稳定性
D.装置④为配制溶液过程中的定容操作
难度: 中等查看答案及解析
-
下列说法正确的是
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成
C.钠、镁着火时,不可用泡沫灭火器灭火
D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
难度: 简单查看答案及解析
-
对下列各组中的实验步骤和现象,分析正确的一项是
选项
实验现象
原因分析
A
证明酸性条件下H2O2氧化性比I2强
碘化钠溶液
溶液变蓝色
B
新制氯水中滴加石蕊试液,溶液先变红,后褪色
氯气与水反应生成HCl、HClO,HCl、HClO显酸性,使石蕊变红,Cl2具有强氧化性,使其褪色
C
SO2通人溴水中,溴水褪色
SO2具有漂白性,使其褪色
D
向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀
在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序号
反应物
产 物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4
②
C12、FeBr2
FeCl3、FeBr3
③
MnO4-
C12、Mn2+
A.氧化性由强到弱顺序为MnO4-> C12>Fe3+>Br2
B.第①组反应的氧化产物为O2
C.第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2
D.第③组反应中生成1mol Cl2,转移电子2mol
难度: 中等查看答案及解析
-
某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
检测序号
溶液中检测出的离子组合
第一次
KCl、K2SO4、Na2CO3、NaCl
第二次
KCl、AlCl3、Na2SO4、K2CO3
第三次
Na2SO4、KCl、K2CO3、NaCl
则下列说法合理的是
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验SO42-,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO32-,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
难度: 困难查看答案及解析
-
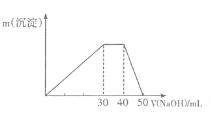
现将足量的CO2气体不断通人到含KOH、Ba(OH)2、K[Al(OH)4]的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
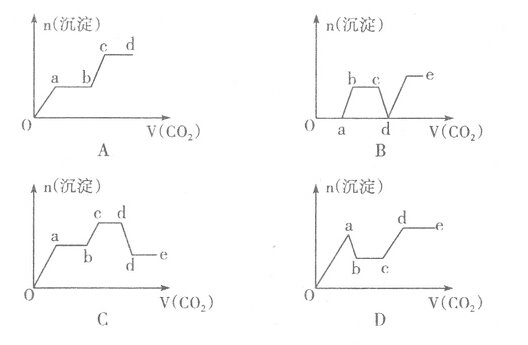
难度: 困难查看答案及解析