-
下列对化学反应的认识正确的是( )
A.化学反应过程中,分子的种类和数目一定发生改变
B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形成
D.反应物的总焓大于反应产物的总焓时,△H>0难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.反应物的分子的每次碰撞都能发生化学反应
B.反应物分子(或离子)间的每次碰撞是反应的先决条件
C.参加反应的物质的性质是决定化学反应速率的重要因素
D.活化分子具有比普通分子更高的能量难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量
B.已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁难度: 中等查看答案及解析
-
下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在无色的溶液中:K+、Na+、HCO3-、I-、MnO4-
B.在使酚酞变红的溶液中:Na+、Fe3+、SO42-、NO3-、HSO3-
C.在c(H+)=10-13mol•L-1的溶液中:Na+、K+、AlO2-、CO32-、SO42-
D.在硝酸钾溶液中:Cu2+、Fe2+、Cl-、SO42-、H+难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.Ca(HCO3)2溶液中加入过量NaOH溶液Ca2++HCO3-+OH-=CaCO3↓+H2O
B.SO2通入溴水中SO2+Br2+2H2O═
C.Cu片插入AgNO3溶液中Cu+Ag+═Cu2++Ag
D.FeO与稀HNO3反应FeO+2H+═Fe2++H2O难度: 中等查看答案及解析
-
对于可逆反应H2(g)+I2(g)⇌2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,一定有c(H2)=c(HI)难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快产生气泡的速率
B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
C.电镀时,应把镀件置于电解槽的阴极
D.钢铁表面常易锈蚀生成Fe2O3•nH2O难度: 中等查看答案及解析
-
下列实验操作或对实验事实的叙述中不正确的是( )
A.用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶待用
B.室温下,测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1CH3COONa溶液的pH,比较HClO和CH3COOH的酸性强弱
C.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
D.配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:定容时仰视刻度线;容量瓶中原有少许蒸馏水难度: 中等查看答案及解析
-
下列各选项所述的两个量中,前者一定大于后者的是( )
A.纯水在100℃和25℃时pH
B.NH4Cl溶液中NH和Cl-的数目
C.相同温度下,pH相同的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-)
D.用0.1 mol/L的盐酸中和pH、体积均相同的氨水和NaOH溶液,所消耗盐酸的体积难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )物质 X Y Z 初始浓度/mol•L-1 0.1 0.2 平衡浓度/mol•L-1 0.05 0.05 0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y⇌2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数难度: 中等查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
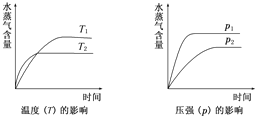
A.CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0
C.CH3CH20H(g)⇌CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH=CH2(g)+2H2O(g);△H<0难度: 中等查看答案及解析
-
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近呈蓝色.下列说法正确的是( )
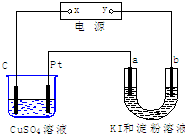
A.x是正极,y是负极
B.x是负极,y是正极
C.a极和Pt产生气体的物质的量相同
D.CuSO4溶液pH值不变,U形管溶液pH值增大难度: 中等查看答案及解析
-
在25℃的条件下,将体积都为10mL,pH=3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a<b
B.a>b
C.a=b=10 mL
D.a=b>10 mL难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向0.1 mol•L-1NH4HSO4溶液中滴加等物质的量溶质的NaOH溶液:[Na+]=[SO]>[NH
]>[OH-]=[H+]
B.0.1 mol•L-1NaHCO3溶液:[Na+]>[OH-]>[HCO]>[H+]
C.Na2CO3溶液:[OH-]-[H+]=[HCO]+2[H2CO3]
D.25℃时,pH=4.75,浓度均为0.1 mol•L-1的CH3COOH、CH3COONa混合溶液:[CH3COO-]+[OH-]<[CH3COOH]+[H+]难度: 中等查看答案及解析
-
常温下,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4难度: 中等查看答案及解析
-
将足量AgCl分别放入下列物质中,AgCl的溶解度由大到小排列顺序是( )
①20mL 0.01mol•L-1KCl溶液
②30mL 0.02mol•L-1CaCl2溶液
③40mL 0.03mol•L-1 HCl溶液
④10mL蒸馏水
⑤50mL 0.05mol•L-1 AgNO3溶液.
A.①>②>③>④>⑤
B.④>③>⑤>②>①
C.⑤>④>②>①>③
D.④>①>③>②>⑤难度: 中等查看答案及解析