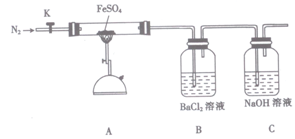
-
下列实验操作能达到相应实验目的的是( )
A.向0.1 mol·L-1的硫酸中滴入几滴甲基橙溶液,溶液变黄
B.将CH4和C2H4的混合气体通过酸性KMnO4溶液可得纯净的C2H4
C.提纯混有乙酸和乙醇的乙酸乙酯,用饱和Na2CO3溶液洗涤、分液并干燥
D.制备Fe(OH)3胶体时,可在FeC13溶液中加入足量NaOH溶液并煮沸
难度: 中等查看答案及解析
-
2016年6月25日,我国新一代运载火箭长征七号在海南文昌反射成功。“长征七号”运载火箭使用的是液氧煤油推进剂,下列说法不正确的是( )
A.工业上通过将空气冷凝成液体后再分离的方式获得液氧
B.推进剂燃烧后的主要产物是水和二氧化碳
C.煤油属于纯净物,主要成分是烃
D.氧气与煤油的反应是放热反应
难度: 简单查看答案及解析
-
战国所著《周礼》中记载沿海古人“煤饼烧砺房成灰”(“砺房” 即牡蜗壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是( )
A.CaO B.Na2CO3 C.SiO2 D.CaCO3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.2—甲基戊烷也称为新戊烷 B.由苯制取溴苯的反应属于加成反应
C.C2H4Br2有2种同分异构体 D.乙醇和乙酸均为非电解质
难度: 中等查看答案及解析
-
下列物质的用途不正确的是( )

难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(OH-)=0.1mol·L-1的溶液:K+、SO42-、Na+、Cl-
B.能使紫色石蕊试液变蓝的溶液:Ag+、Fe3+、Br-、SO42-
C.pH=1的溶液:Na+、Ca2+、HCO3-、ClO-
D.与Al反应能放出H2的溶液:Fe2+、Ba2+、NO3-、SO42-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A.44g由CO2和N2O组成的混合气体中的氧原子数为2NA
B.1 mol 由异丁烷和正丁烷组成的混合物中含有的共价键数目为13NA
C.2 mol SO2与2molO2充分反应生成的S03分子数为2NA
D.100mL12mol·L-1浓盐酸与足量MnO2反应,转移的电子数为0.6NA
难度: 中等查看答案及解析
-
有机物M是一种香料的合成原料,其结构简式如图所示。下列有关M的说法正确的是
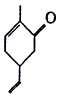
A. 可以发生氧化反应 B. 分子式为C9H10O
C. 分子中所有原子都处于同一平面上 D. 能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
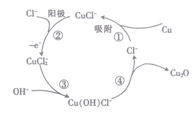
一种制取粗碘的工艺流程如图所示,下列有关说法不正确的是( )
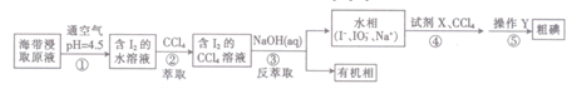
A.步骤②中的萃取过程为物理变化
B.步骤③发生的反应中I2是氧化剂,NaOH是还原剂
C.步骤④所加的试剂X可能是稀硫酸
D.步骤⑤涉及的主要操作Y为分液和蒸馏
难度: 中等查看答案及解析
-
下列有关NaHCO3溶液的说法错误的是( )
A.该溶液中c(H2CO3)>c(CO32-)
B.常温下,该溶液的pH>7
C.该溶液中阳离子总数小于阴离子总数
D.常温下,加水稀释时
 不变
不变难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论均正确且两者具有因果关系的是( )

难度: 中等查看答案及解析
-
一种锂钒氧化物热电池装置如图所示。其电池总反应为xLi+LiVO8=Li1+xV3O8,工作时需先引发铁和氯酸钾反应使共晶盐融化。下列说法正确的是( )
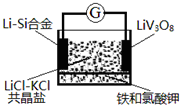
A.Li—Si合金为该热电池的正极
B.电池放电时Cl-移向LiV308电极
C.LiCl-KCl共晶盐可用LiCl和KCl的混合水溶液代替
D.放电时,正极反应式为LiV3O8+xLi++xe-=Li1+xV3O8
难度: 困难查看答案及解析
-
用0.1mol·L-1的NaOH溶液滴定25mL0.1mol·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )

A.草酸是弱酸
B.X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-)
C.Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+)
D.滴定过程中始终存在:c(OH-)+2c(C2O42-)+ c(HC2O4-)= c(Na+)+ c(H+)
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体, m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是( )
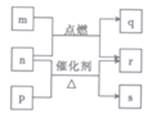
A. 原子半径:X<Y<Z B. 非金属性:X>Y>Z
C. q与s均为酸性氧化物 D. X 的单质与Y 的单质在一定条件下能发生反应
难度: 困难查看答案及解析
 )分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。
)分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。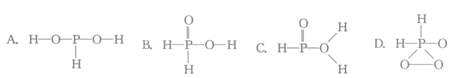

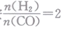 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。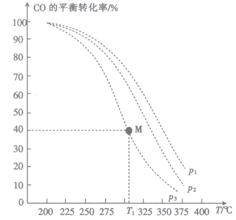


 其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。