-
下列有关化学用语表示正确的是
A.乙酸的结构简式:C2H4O2
B.S2—的结构示意图:
C.质子数为53、中子数为78的碘原子:
D.CO2的电子式

难度: 简单查看答案及解析
-
下列说法中,正确的是
A.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水
C.FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应
D.将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙
难度: 中等查看答案及解析
-
具有相同的电子层结构的四种微粒:aAn+、bB(n+1)+、cCn-、dD(n+1)-,关于A、B、C、D四种元素叙述正确的是
A.一定都是短周期元素
B.原子序数:B > A > C > D
C.单质的还原性:B > A
D.气态氢化物的稳定性:D > C
难度: 中等查看答案及解析
-
如图是制备和收集气体的实验装置,该装置可用于
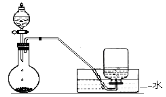
A.浓硝酸与铜反应制取二氧化氮
B.碳化钙与食盐水反应制取乙炔
C.浓氨水和生石灰反应制取氨气
D.浓盐酸和二氧化锰反应制取氯气
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol OH- 中含有10NA个电子
B. 46g的NO2气体中含有NA个NO2分子
C.1 L 1 mol/L的AlCl3溶液中含有NA个Al3+
D.常温常压下11.2 L的甲烷气体含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列各组离子能大量共存的是
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH4+、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+
④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+
⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-
A.③④ B.①③ C.①⑤ D.②③
难度: 困难查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
R
W
原子半径/pm
160
143
89
70
66
主要化合价
+2
+3
+2
+5、-3
-2
下列叙述正确的是
A.X、Z元素的金属性:X < Z
B.一定条件下,R单质与常见的W单质能直接生成RW2
C.气态氢化物的稳定性:R > W
D.Y的最高价氧化物既能溶于H2SO4又能溶于NaOH
难度: 中等查看答案及解析
-
下表中各组物质不能实现如图转化的是
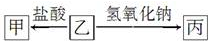
甲
乙
丙
A
AlCl3
Al
Al(OH)3
B
AlCl3
Al(OH)3
NaAlO2
C
CO2
NaHCO3
Na2CO3
D
CO2
(NH4)2CO3
NH3
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、SO32-、CO32-、CH3COO- 等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
A. HCO3- B.SO32- C.CO32- D.CH3COO-
难度: 中等查看答案及解析
-
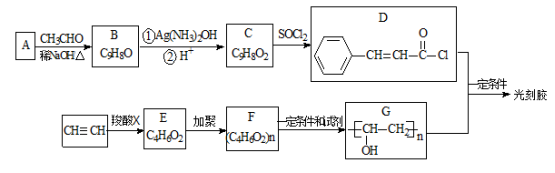
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
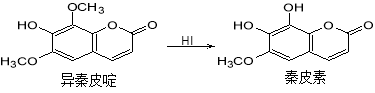
A.异秦皮啶与秦皮素互为同系物
B.异秦皮啶分子式为C11H12O5
C.秦皮素一定条件下能发生加成反应、消去反应和取代反应
D.1mol秦皮素最多可与2molBr2(浓溴水中的)、4molNaOH反应
难度: 中等查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将FeCl3饱和溶液滴入沸水中可制得Fe(OH)3胶体
B.AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3
C.向FeBr2溶液中通入过量Cl2 ,加CCl4振荡静置,上层液体无色、下层为橙红色
D.将Cl2通入Na2SO3溶液中,检验是否有SO42-生成,可向该溶液中滴加足量盐酸酸化的Ba(NO3)2溶液
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol·L-1的NaCl溶液中,Na+数目为NA
B.标准状况下,1 mol Cl2溶于水,转移电子的数目为NA
C.1 mol Na2O和1 mol Na2O2中,所含阴离子的数目均为NA
D.含2 mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为NA
难度: 中等查看答案及解析
-
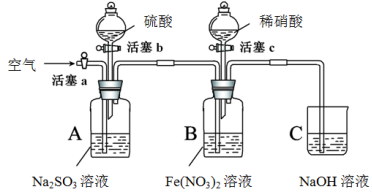
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量BaCl2溶液的洗气瓶中(如图装置),下列有关说法正确的是
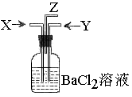
A.集气瓶中产生的沉淀是BaSO4
B.Z导管出来的气体中无CO2
C.Z导管口没有红棕色气体出现
D.集气瓶中产生的沉淀是BaCO3
难度: 困难查看答案及解析
-
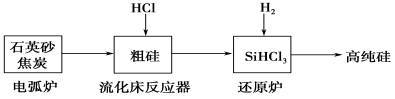
从海带中提取碘单质,成熟的工艺流程如下,下列关于海带制碘的说法,不正确的是

A.实验室在坩埚中灼烧干海带,使有机碘转化为无机碘(I-)并富集
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水中加入CCl4得到I2的CCl4溶液,该操作为“分液”
难度: 中等查看答案及解析
-
粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素单质相似,都是较强的氧化剂,而且受热时ICl和IBr皆可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是
A.H2O B.Zn C.KI D.KCl
难度: 中等查看答案及解析
-
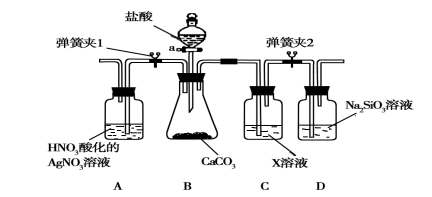
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
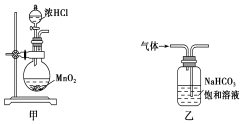
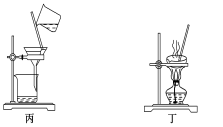
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离氯化锰溶液和二氧化锰
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
与下列实验事实所对应的相应结论正确的是
实验事实
结论
①
HCl的水溶液中存在H+和Cl-
HCl是离子化合物
②
NO2通入水中,发生反应,产物中有HNO3
NO2是酸性氧化物
③
向FeCl3溶液中加入铜片,溶液逐渐变为蓝色
氧化性:Fe3+ > Cu2+
④
等物质的量的Na和Al都完全反应,Al失电子多
金属性:Al > Na
⑤
某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中一定有NH4+
A. ①② B.①②④ C.③⑤ D.③④⑤
难度: 中等查看答案及解析
-
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)

a
b
c
d
①
Si
SiO2
H2SiO3
Na2SiO3
②
N2
NO
NO2
HNO3
③
Cu
CuO
Cu(OH)2
CuSO4
④
Na
NaOH
Na2CO3
NaHCO3
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述正确的是。
A.反应中共消耗1.85 mol H2SO4 B.气体甲中SO2与H2的体积比为1∶4
C.反应中共消耗65 g Zn D.反应中共转移3.6 mol电子
难度: 困难查看答案及解析